
 “五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究.
“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究.| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 30% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
分析 (1)根据稀硫酸与锌反应产生硫酸锌和氢气进行分析;
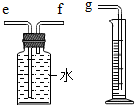
(2)为测定所收集氢气的体积,则需要采用液体等量代换的方式,因此可以选用右图这样的装置,短进长出,让里面的水等量流到量筒内,通过量筒内液体的体积判断收集的气体的体积;
(3)根据二氧化碳会与水反应进行分析;
(4)对比四个实验,利用控制变量法选择合适的对比组;
(5)通过不同质量分数的硫酸与锌反应产生氢气的快慢得出结论;
(6)根据表格的数据总结产生的氢气与时间的关系并分析原因;
(7)反应物浓度、反应温度、反应物接触面积、有无催化剂等因素常影响化学反应速率,利用控制变量的思想设计一个因素对反应速率的影响.
解答 解:(1)稀硫酸与锌反应产生硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
(2)因为氢气不易溶于水,可以通过压强的变化利用排水法把水压入量筒内,根据进入量筒中水的体积,判断生成氢气的体积,所以进气管是短管f;
(3)二氧化碳会与水反应,所以用该收集CO2,并测量生成的CO2气体的体积,其中在水面上放一层植物油目的是:防止二氧化碳与水反应;
(4)要比较不同质量分数的硫酸对反应快慢的影响,其中的锌的状态保持不变,选择不同质量分数的硫酸,看产生氢气的快慢,因此可以选择①③或②④;
(5)通过①③(都是锌粒,硫酸的质量分数不同),可以看出:硫酸的质量分数越大,反应速率越快;通过①②(锌粒和锌片与质量分数相同的硫酸反应)可以看出:锌与硫酸的接触面积越大,反应速率越快;
(6)从表格可以看出反应由慢到快然后逐渐减慢;因为随着反应的进行,反应放出热量,反应速度加快,但随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢;
(7)如设计温度对反应快慢的影响,具体的操作为:取质量相等的锌粒分别放入两只试管中,然后分别加入温度不同,体积和溶质质量分数相同的稀硫酸,测量收集等体积的氢气所需要的时间.
故答案为:(1)Zn+H2SO4=ZnSO4+H2↑;
(2)根据进入量筒中水的体积,判断生成氢气的体积,f;
(3)防止二氧化碳与水反应;
(4)①③或②④;
(5)在相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快;
(6)由慢到快然后逐渐减慢;因为随着反应的进行,反应放出热量,反应速度加快,但随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢;
(7)温度;取质量相等的锌粒分别放入两只试管中,然后分别加入温度不同,体积和溶质质量分数相同的稀硫酸,测量收集等体积的氢气所需要的时间.
点评 本题以影响产生氢气的反应速率为实验探究的形式考查了反应物浓度、颗粒的大小、反应温度等因素对化学反应速率的影响,重点在于培养学生的实验探究能力,注意控制变量的运用.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:初中化学 来源: 题型:解答题
 在做盐跟盐酸反应的分组实验时,第一组同学进行BaCl2与Na2CO3溶液的反应,第二组同学进行BaCl2与Na2SO4溶液的反应,实验结束后,两组同学将全部的浊液集中倒进一个废液缸中,化学兴趣小组对浊液进行过滤,探究滤液的成分.
在做盐跟盐酸反应的分组实验时,第一组同学进行BaCl2与Na2CO3溶液的反应,第二组同学进行BaCl2与Na2SO4溶液的反应,实验结束后,两组同学将全部的浊液集中倒进一个废液缸中,化学兴趣小组对浊液进行过滤,探究滤液的成分.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在氢气中,氢元素的化合价为+1价 | |
| B. | 在氯化钠中,钠元素的化合价为-1价 | |
| C. | 在二氧化硅中,氧元素的化合价为+2价 | |
| D. | 化合价是元素的原子在形成化合物时表现出的一种性质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
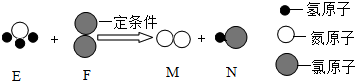 已知两种分子E和F反应生成另外两种分子M和N(如图所示).下列判断正确的是( )
已知两种分子E和F反应生成另外两种分子M和N(如图所示).下列判断正确的是( )| A. | 化学反应前后原子的数目发生了改变 | |
| B. | E中氮氢元素的质量比为1:3 | |
| C. | N中氯元素的化合价为+1价 | |
| D. | 该反应的化学方程式为2NH3+3Cl2$\frac{\underline{\;一定条件\;}}{\;}$N2+6HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧时,发出微弱的淡蓝色火焰 | |
| B. | 铁丝在氧气中燃烧时,火星四射,生成红色固体 | |
| C. | 镁条在空气中燃烧时,发出耀眼的白光,生成白色固体 | |
| D. | 红磷在空气中燃烧时,产生大量白色烟雾 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 图1为精制粗盐的示意图,回答:
图1为精制粗盐的示意图,回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
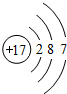 ,氯原子的最外层电子数为7.图中微粒共表示三种元素,其中与氯原子具有相似化学性质的是D(填序号).
,氯原子的最外层电子数为7.图中微粒共表示三种元素,其中与氯原子具有相似化学性质的是D(填序号).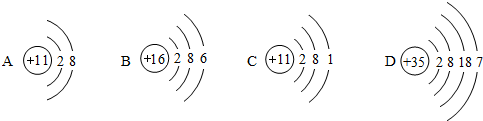
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com