
【题目】已知草酸 (H2C2O4) 加热时在浓硫酸的催化作用下会发生分解反应,某化学兴趣小组对草酸分解的产物产生了兴趣,请你参与:
(1)【提出猜想】甲:CO2 H2O;乙:CO H2O;丙:NH3 CO2 H2O;丁:CO2 CO H2O.
某同学认为丙同学的猜想是错误的,理由是 .
【查阅资料】氧化铁为红棕色粉末,一定温度CO能还原氧化铁;铁粉呈黑色.
(2)【进行实验】为了验证上述猜想,将草酸在一定条件下分解的产物依次通过如图所示的装置: 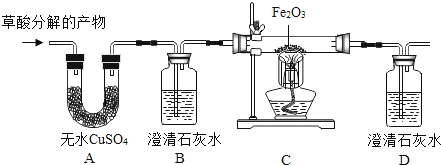
①A、B装置的顺序不能颠倒,原因是 .
②实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红棕色粉末变成黑色,由此推断同学猜想成立.
③D装置的作用是 , 反应的化学方程式为 .
(3)【得出结论】草酸分解的化学方程式为 .
(4)【反思与评价】从环保角度考虑,上述实验的不足之处是 .
【答案】
(1)根据质量守恒定律或化学反应前后元素种类不变或反应前不含氮元素
(2)先通过装置B,会干扰对水的鉴别;丁;吸收和检验二氧化碳,并收集尾气;Ca(OH)2+CO2=CaCO3↓+H2O
(3)[ "H2C2O4![]() (4)装置D后缺少尾气处理装置
(4)装置D后缺少尾气处理装置
【解析】【提出猜想】已知草酸(H2C2O4)加热时在浓硫酸的作用下会发生分解反应,而丙的猜想为:NH3、CO2 、H2O;但是根据质量守恒定律,产物中是不可能出现氮元素的,故丙同学的猜想错误,则答案为:根据质量守恒定律或化学反应前后元素种类不变或反应前不含氮元素;
【进行实验】①从装置B出来的气体会带有水分,如果A、B装置的顺序颠倒,将会干扰对水的鉴别;所以答案是:先通过装置B,会干扰对水的鉴别;
②装置A中无水硫酸铜变蓝,说明有水;装置B中澄清石灰水变浑浊,说明有二氧化碳;C中红棕色粉末变成黑色,说明有一氧化碳,根据实验的现象,可推断丁同学猜想成立.
③D装置的作用是吸收和检验二氧化碳,并收集尾气,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,书写化学方程式配平即可;所以答案是:Ca(OH)2+CO2═CaCO3↓+H2O;
【得出结论】草酸在浓硫酸做催化剂和加热的条件下生成水、二氧化碳和一氧化碳,书写化学方程式配平即可;所以答案是:H2C2O4 ![]() CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
【反思与评价】从环保角度考虑,装置D后应该有尾气处理装置;所以答案是:装置D后缺少尾气处理装置.
【考点精析】根据题目的已知条件,利用二氧化碳的化学性质和一氧化碳的性质的相关知识可以得到问题的答案,需要掌握化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应;一氧化碳的物理性质:无色,无味的气体,密度比空气略小,难溶于水;一氧化碳的化学性质:可燃性和还原性.


科目:初中化学 来源: 题型:
【题目】人剧烈运动后,血液中产生较多乳酸(化学式为C3H6O3)。下则有关乳酸说法正确的是
A. 乳酸不属于有机化合物
B. 一个乳酸分子中含有12个原子
C. 乳酸的相对分子质量为90g
D. 乳酸中C、H、O三种元素的质量比为1:2:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下面是对铁的锈蚀条件的探究.因通常实验中铁生锈所需要时间较长,某实验小组设计了如图所示的改进实验. 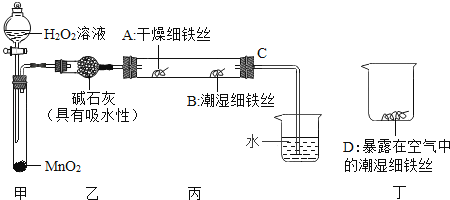
(1)检查装置的气密性:连接好装置,关闭分液漏斗的旋塞,将C导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是 .
(2)反应开始后,甲装置中的反应现象: , MnO2的作用: .
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮,A、B处实验现象对比,可得出铁生锈与有关;B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过滤可以除去不溶于水中的________(可溶性或不溶性)杂质,使用活性炭可以滤去其中的不溶性物质,还可以________一些可溶解的杂质,如臭味。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于空气的说法正确的是
A. 空气中的氮气约占总体积的21%
B. 空气中的氧气能支持燃烧
C. 空气中的稀有气体没有任何用途
D. 空气中的二氧化碳会造成酸雨
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列描述不正确的是
A. CO有毒且无色无味,使用燃气时要注意室内通风
B. CO2作为气体肥料在农业生产中有广泛应用
C. N2充入食品包装袋中可起防腐作用
D. CH4在空气中燃烧是化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示的实验装置,探究影响过氧化氢分解速率的因素。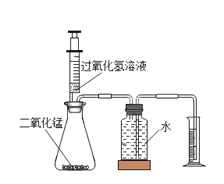
(1)写出过氧化氢分解的化学方程式 ;装置中使用注射器的优点是 。
(2)下面是用上述装置实验时,收集的相关数据:
实验 | H2O2溶液浓度/% | 体积/mL | MnO2的量/g | 温度/℃ | 收集的体积/mL | 反应所需的时间/s |
① | 5 | 2 | 0.1 | 20 | 4 | 18 |
② | 10 | 2 | 0.1 | 20 | 4 | 6 |
③ | 5 | 2 | / | 20 | 4 | 64 |
④ | 5 | 2 | / | 60 | 4 | 25 |
从实验①和②对比可知,化学反应速率与有关;
从实验③和④对比可知,化学反应速率与有关;
从实验对比可知,化学反应速率是否加MnO2有关。
(3)发现问题:实验温度最难控制,反应一段时间后溶液的温度总是比起始温度高,说明反应(填“放出”或“吸收”)热量
(4)继续探究:除了该实验小组探究过的因素以外,你若还有其他影响反应速率的因素及探究方法,请写在下面。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com