
化学反应中的热现象给人们的生活和生产活动带来很多好处的同时,也带来了一些不便,如:食物的________,粮库中的粮食时间长了会发生________,甚至导致________.
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:
| 化学反应 | 化学方程式 | 简答 | ||||||||
| 二氧化碳 通入水中 |
CO2+H2O═H2CO3 CO2+H2O═H2CO3 |
反应类型 化合反应 化合反应 | ||||||||
| 铁丝在氧气 中燃烧 |
3Fe+2O2
3Fe+2O2
|
反应现象 剧烈燃烧,火星四射 剧烈燃烧,火星四射 放出大量的热,生成一种黑色固体 放出大量的热,生成一种黑色固体 | ||||||||
| 水在通电的 条件下反应 |
2H2O
2H2O
|
各生成物的质量比为 9:1:8 9:1:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
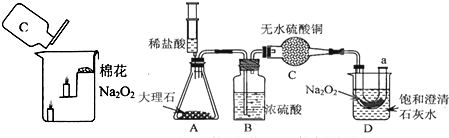
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com