
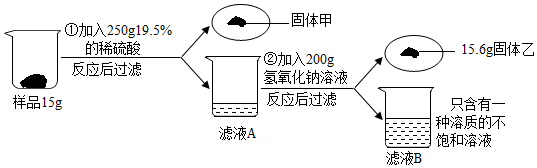
分析 (1)根据氧化铝与硫酸的反应写出反应的化学方程式;
(2)根据上述反应分析滤液中的溶质;
(3)根据固体乙的质量计算所消耗的氢氧化钠质量、参加反应的硫酸铝的质量、生成硫酸钠的质量;
(4)根据硫酸铝的质量计算氧化铝的质量及样品中氧化铝的质量分数;
(5)根据溶质的质量分数计算溶液中溶质的质量分数;
(6)根据氧化铝的质量计算可以生产含杂质4%的铝的质量.
解答 解:(1)由实验的过程可知,实验①中氧化铝与硫酸反应生成了氧化铝和水,发生反应的化学方程式:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)由上述反应可知,滤液A中溶质是硫酸铝,化学式是:Al2(SO4)3;
(3)设15.6g固体乙所消耗的氢氧化钠质量为x,硫酸铝的质量为y,生成的硫酸钠的质量为z
Al2(SO4)3+6NaOH=2Al(OH)3+3Na2SO4
342 240 156 426
y x 15.6g z
所以固体乙所消耗的氢氧化钠质量(X)的比例式是:$\frac{240}{156}=\frac{x}{15.6g}$
$\frac{342}{y}=\frac{156}{15.6g}=\frac{426}{z}$ 解得:y=34.2g z=42.6g;
(4)设氧化铝的质量为m
Al2O3+3H2SO4=Al2(SO4)3+3H2O
102 342
m 34.2g
$\frac{102}{342}=\frac{m}{34.2g}$ 解得:m=10.2g
样品中氧化铝的质量分数为:$\frac{10.2g}{15g}×100%$=68%
(5)溶液中溶质的质量分数为:$\frac{42.6g}{10.2g+250g+200g+55.4g-15.6g}×100%$=8.52%
(6)设生产的铝的质量为n
2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
204 108
120t×68% n
$\frac{204}{108}=\frac{120t×68%}{n}$ 解得:n=43.2t
若再生成过程中铝的损失为10%,则可以生产含杂质4%的铝的质量为:43.2t×(1-10%)÷(1-4%)=40.5t.
故答为:(1)Al2O3+3H2SO4=Al2(SO4)3+3H2O;(2)Al2(SO4)3;(3)$\frac{240}{156}=\frac{x}{15.6g}$;(4)68%;(5)8.52%;(6)40.5t.
点评 本题通过测定铝土矿石中氧化铝的含量的实验过程考查了化学方程式的书写、根据化学方程式的计算和溶质质量分数的计算等知识.都是教材中的重要知识点,应加强学习.


科目:初中化学 来源: 题型:选择题
| 实验内容 | 实验现象 | 实验结论 | |
| A | 高温下,将一氧化碳通过氧化铁粉末 | 红色粉末变为黑色 | 一氧化碳具有还原性 |
| B | 将二氧化碳通入紫色石蕊溶液中 | 紫色石蕊溶液变红色 | 二氧化碳显酸性 |
| C | 某气体通入澄清石灰水 | 出现白色浑浊 | 该气体可能是CO2 |
| D | 某溶液中滴入氯化钡试剂 | 有白色沉淀 | 该溶液中可能含有CO32-SO42-或Ag+等离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
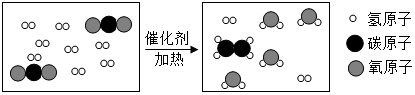 科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示.下列说法不正确的是( )
科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示.下列说法不正确的是( )| A. | 参加反应的两种分子的个数比是1:4 | |
| B. | 反应中没有单质生成 | |
| C. | 反应前后原子种类、数目均不变 | |
| D. | 乙烯的化学式为C2H4 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 我国科学家屠呦呦因发现青蒿素(化学式为C15H22O5,一种用于治疗疟疾的药物)而获得诺贝尔奖.回答:
我国科学家屠呦呦因发现青蒿素(化学式为C15H22O5,一种用于治疗疟疾的药物)而获得诺贝尔奖.回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 名称 | 洗洁精 | 炉具清洁剂 | 洁厕灵 | “84”消毒液 |
| 有效成分 | 表面活性剂 | 氢氧化钠 | 盐酸 | 次氯酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com