(2012?镇江一模)工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”.
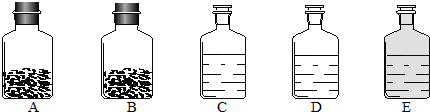
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是
浓硝酸
浓硝酸
(填名称);②分别打开C、D瓶的瓶塞,观察到
C瓶口产生白雾
C瓶口产生白雾
,说明C瓶内的是浓盐酸,则D瓶内的是浓硫酸.
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图.

注:整个框图中每个化学反应涉及的物质已全部给出.
根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题.
写出下列物质化学式:A瓶内的物质:
NaOH
NaOH
.
小袁同学认为工业生产中原料不能完全转化为产品,所以A瓶内的物质中一定含有杂质.请你帮助他设计出检验该杂质的实验方案(写出操作、现象和结论):
取适量溶液滴加硝酸银,若产生白色沉淀,再滴加稀硝酸,沉淀不溶解,则含有氯化钠
取适量溶液滴加硝酸银,若产生白色沉淀,再滴加稀硝酸,沉淀不溶解,则含有氯化钠
(3)小军对A瓶放置一段时间后白色粉末的成分进行探究.成分的确定作出以下的猜想:①可能是NaOH;②可能是Na
2CO
3;③可能是NaOH与Na
2CO
3的混合物.做出②③猜想的依据是
CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
(用化学方程式表示)为了验证①②③猜想,他分别做了下面的实验.A.取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有,肯定猜想
①
①
(填序号)是错误的.B.小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.于是认为猜想3成立,请提出你的看法,并说出理由:
错误,因为碳酸钠溶液也显碱性
错误,因为碳酸钠溶液也显碱性
.C.为探究猜想③是正确的,小红设计了如下实验方案:
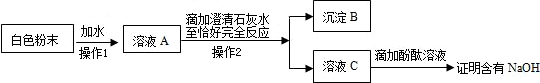
沉淀B的化学式为
CaCO3
CaCO3
.你若认为小红的这个方案有问题,稍加改进,就可以证明粉末中还含有NaOH,则改进的方法是
将石灰水换成氯化钙溶液
将石灰水换成氯化钙溶液
.
(4)过氧化钠(Na
2O
2)是一种白色固体,这种物质在与水或二氧化碳作用时可得到上述的“两碱”,在一次科技活动中,某化学兴趣小组的同学将包有Na
2O
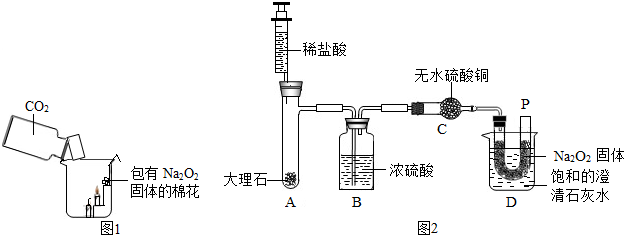
2固体的棉花放入了如图1的实验装置中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
a.棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足
a:
与氧气充分接触
与氧气充分接触
、b
温度达到棉花的着火点
温度达到棉花的着火点
条件.
【提出问题】在上述实验中如何给棉花提供a和b这两个燃烧条件呢?
【查阅资料】1、在常温下Na
2O
2能和CO
2发生化学反应.
2、在常温下Na
2O
2能和水发生反应:2Na
2O
2+2H
2O═4NaOH+O
2↑
3、浓硫酸具有强吸水性.无水硫酸铜为白色固体,吸水后变为蓝色.
【设计实验】经过讨论后,小组同学设计了如下图2的实验进行探究.
【实验步骤】①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有一定量的Na
2O
2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针管的活塞,把稀盐酸注入试管内;④一段时候后,在P处放置一根带火星的小木条,观察现象.
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响.
【实验现象】①无水硫酸铜没有变蓝色;②带火星的小木条复燃;③饱和澄清石灰水变浑浊.
【实验分析】①C装置无水硫酸铜的作用是
检验水蒸气是否被浓硫酸吸干净
检验水蒸气是否被浓硫酸吸干净
②D装置的烧杯内饱和的澄清石灰水的作用是
证明二氧化碳与过氧化钠反应放出热量
证明二氧化碳与过氧化钠反应放出热量
(5)现要对放置一段时间的B瓶中的固体物质进行成分的定量测定:电子天平共同作了以下测定

实验数据记录如下:
| 称 量 项 目 |
称 量 时 间 |
质量(g) |
| 试样 |
|
10.00 |
| 装置+稀硫酸质量 |
|
241.30 |
| 装置+稀硫酸质量+试样 |
反应开始后15秒 |
249.20 |
| 装置+稀硫酸质量+试样 |
反应开始后35秒 |
248.20 |
| 装置+稀硫酸质量+试样 |
反应开始后55秒 |
248.00 |
试通过分析表中数据计算出图2B瓶中纯碳酸钠的质量分数.(写出计算过程)
实验反思:
有同学提出按上述实验所测得试样中Na
2CO
3质量分数会偏小,该同学的理由是(实验操作均正确):
因为二氧化碳的密度比空气大,会有二氧化碳残留在装置内,使质量差变小,使测得试样中Na2CO3质量分数会偏小
因为二氧化碳的密度比空气大,会有二氧化碳残留在装置内,使质量差变小,使测得试样中Na2CO3质量分数会偏小
.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案
 做化学实验时,实验台上的药品应分类有序地摆放.在一次化学兴趣小组活动中,实验台上摆放了下列药品,①盐酸,②硫酸,③氢氧化钾,④氢氧化钙,⑤硝酸银,⑥
做化学实验时,实验台上的药品应分类有序地摆放.在一次化学兴趣小组活动中,实验台上摆放了下列药品,①盐酸,②硫酸,③氢氧化钾,④氢氧化钙,⑤硝酸银,⑥ 我市石灰石资源丰富,这为我市发展建材工业提供了得天独厚的条件.我市某校九年级化学研究性学习小组的同学,在课外的探究活动中采集了当地一座山上的石灰石样品,并通过实验测定石灰石样品中碳酸钙的含量.他们取100g石灰石样品(杂质不与酸或水反应)放入烧杯中并加入300g稀盐酸,恰好完全反应.把产生的二氧化碳气体用足量的石灰水吸收,同时测量3分钟内烧杯内增重的质量,结果如下表:
我市石灰石资源丰富,这为我市发展建材工业提供了得天独厚的条件.我市某校九年级化学研究性学习小组的同学,在课外的探究活动中采集了当地一座山上的石灰石样品,并通过实验测定石灰石样品中碳酸钙的含量.他们取100g石灰石样品(杂质不与酸或水反应)放入烧杯中并加入300g稀盐酸,恰好完全反应.把产生的二氧化碳气体用足量的石灰水吸收,同时测量3分钟内烧杯内增重的质量,结果如下表:



