
| A. | 纯碱 胆矾 硫酸钠 | B. | 烧碱 纯碱 熟石灰 | ||
| C. | 干冰 冰 金刚石 | D. | 氯化钙 氧化钙 硝酸钙 |
分析 根据物质的组成来分析物质的类别,利用酸、碱、盐的概念来判断物质是否属于同一类别;可以采用排除法(即只要发现选项中有一种不属于同一类别,即可排除该选项)进行快速排除.
解答 解:A、纯碱、胆矾(五水合硫酸铜)、硫酸钠都是由金属阳离子和酸根离子构成的,则都属于盐,故选项正确.
B、烧碱(氢氧化钠)、熟石灰(氢氧化钙)都是由金属阳离子和OH-构成的,都属于碱;而纯碱(碳酸钠)是金属阳离子和酸根离子构成,属于盐;故选项错误.
C、干冰(固态的二氧化碳)、冰(固态的水)都是由两种元素组成的且有一种是氧元素的化合物,都属于氧化物;而金刚石是由一种元素组成的纯净物,属于单质;故选项错误.
D、氯化钙、硝酸钙都是由金属阳离子和酸根离子构成的,则都属于盐;而氧化钙是由两种元素组成的且有一种是氧元素的化合物,属于氧化物;故选项错误.
故选A.
点评 本题难度不大,考查物质类别的判别,抓住单质、氧化物、酸、碱、盐的特征,熟悉常见的物质的组成是正确解答本题的关键.


科目:初中化学 来源: 题型:实验探究题
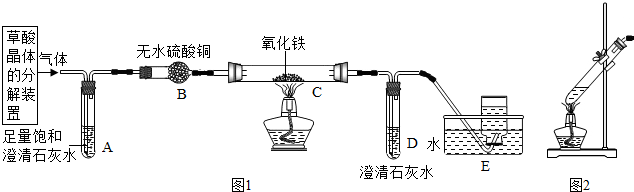
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
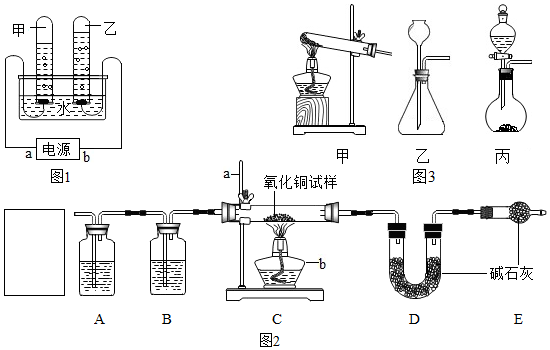
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
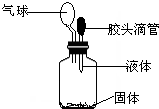 要使如图装置中的小气球鼓起来,则使用的固体和液体可以是( )
要使如图装置中的小气球鼓起来,则使用的固体和液体可以是( )| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
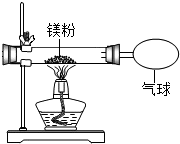 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.| 实验操作 | 实验现象 | 结论 |
| 取燃烧后的产物于试管中,加少量水,再将湿润的红色石蕊试纸放在试管口,观察现象. | 试管中有气体产生,湿润的红色石蕊试纸变蓝 | 燃烧产物中含有Mg3N2 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
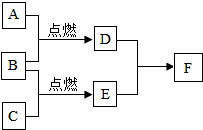 已知A、B、C、D、E、F六种物质间有如下的转变关系(发生的反应都是化和反应),其中A、B、C在通常情况下是三种无色无味的气体,且C为化合物,D是一种无色的液体氧化物,F是一种能使紫色石蕊试液变红的物质.
已知A、B、C、D、E、F六种物质间有如下的转变关系(发生的反应都是化和反应),其中A、B、C在通常情况下是三种无色无味的气体,且C为化合物,D是一种无色的液体氧化物,F是一种能使紫色石蕊试液变红的物质.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 通入澄清石灰水 | B. | 将燃着的木条伸入集气瓶 | ||
| C. | 测定气体的溶解性 | D. | 分别通过加热的木炭粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com