
| X | Y | Z | Q | |
| 反应前的质量/g | 20 | 80 | 2 | 21 |
| 反应后的质量/g | 4 | 待测 | 38 | 65 |
| A. | 反应后物质Y的质量为44g | |
| B. | 反应中物质X与Y发生改变的质量之比为1:4 | |
| C. | 反应中Z可能是催化剂 | |
| D. | 若X和Z的相对分子质量分别是16和18,则他们的化学计量数之比是2:1 |
分析 此题是借助质量守恒定律对反应物生成物先做出判断,再利用质量关系进行求解,反应中反应物质量会减少,生成物质量会增加,从而判断生成物与反应物,即可判断反应的类型,且反应物与生成物质量相等可求出A的质量.
解答 解:A、根据质量守恒定律可知,设待测质量为x,反应前各物质的质量总和=反应后生成各物质的质量总和,则得:20g+80g+2g+21g=x+4g+38g+65g,
解得:x=16g,故A错误;
B、反应过程中,X与Y改变的质量比=(20g-4g):(80g-16g)=16:64=1:4,故B正确;
C、反应后Z的质量明显增加,所以不可能为催化剂,故C错误;
D、设反应中X与Z的化学计量数a和c,则依据方程式中物质的质量关系可知,$\frac{16a}{18c}$=
$\frac{20g-4g}{38g-2g}$,解得a:c=1:2,则X与Y的计量数之比是1:2,故D错误.
故选B.
点评 本题主要考查质量守恒定律的应用、反应物和生成物的判断、各物质的质量比等,难度不大.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:初中化学 来源: 题型:解答题
 人体缺乏维生素C(简写Vc,化学式为C6H8O6))就会患坏血病.如图为某种“维生素C”说明书的一部分.请回答:
人体缺乏维生素C(简写Vc,化学式为C6H8O6))就会患坏血病.如图为某种“维生素C”说明书的一部分.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水通电生成氢气和氧气的体积比为$\frac{1}{2}$ | |
| B. | 硫磺在空气中燃烧发出明亮的蓝紫色火焰 | |
| C. | 红磷在空气中燃烧产生大量白烟 | |
| D. | 镁条在空气中燃烧火星四射 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 实验1观察到试管内先产生蓝色沉淀后沉淀消失,由此证明氢氧化铜与稀盐酸发生反应 | |
| B. | 实验2观察到左侧试管中氢氧化钙粉末未溶解,右侧试管中氢氧化钙粉末溶解,由此判断氢氧化钙与稀盐酸发生反应,实验中必须控制反应物的用量 | |
| C. | 实验3加入的X若为氧化铜,则观察到试管中溶液变为蓝色,从而证明酸与碱发生反应 | |
| D. | 实验3加入的X若为酚酞试液,试液不变色,证明酸与碱发生反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
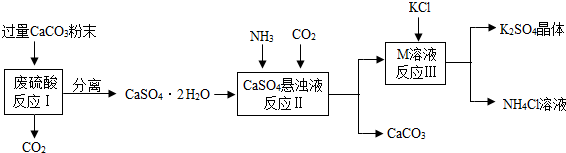
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 序号 | 加入的盐酸/g | 剩余固体/g |
| 1 | 10 | 5.5 |
| 2 | 10 | 3 |
| 3 | 10 | 1.6 |
| 4 | 10 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 我市银滩是国家“AAAA”级滨海旅游度假区,有漫长的海岸线,海洋资源十分丰富,海水中含有大量的化学物质.
我市银滩是国家“AAAA”级滨海旅游度假区,有漫长的海岸线,海洋资源十分丰富,海水中含有大量的化学物质.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
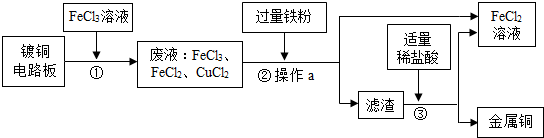
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com