
| 第一次 | 第二次 | 第三次 | |
| 连续加入盐酸的体积(mL) | 10 | 10 | 10 |
| 生成氢气的质量(g) | 0.08 | 0.08 | 0.04 |
分析 (1)两种金属中一种金属的活动性比氢强,一种金属的活动性比氢弱,满足此条件才能测定出铜的质量分数.
(2)根据表格提供的数据,10g盐酸与锌完全反应最多生成0.08g氢气,第三次只生成0.04g,说明金属全部参加了反应,可计算出生成氢气的总质量;由氢气的质量,由反应的化学方程式列式计算出合金中锌的质量、所用盐酸中溶质的质量、完全反应时所得溶液的溶质的质量,进行分析解答.
解答 解:(1)实验室只提供了一瓶稀盐酸,只有两种金属一种能与盐酸反应而另一种不能与盐酸反应才能测出铜的质量分数,合金中Cu-Zn组合符合该条件;Cu-Ag合金中的铜、银均不与稀盐酸反应,不能测出铜的质量分数.
(2)①根据表格提供的数据,10g盐酸与锌完全反应最多生成0.08g氢气,第三次只生成0.04g,说明金属全部参加了反应,故生成氢气的总质量为:0.08g+0.08g+0.04g=0.2g.
②10g盐酸与锌完全反应最多生成0.08g氢气,第三次只生成0.04g,生成第三次加入的盐酸中有5g参加了反应.
设参加反应的锌的质量为x,参加反应的盐酸的质量为y,生成氯化锌的质量为y,
Zn+2HCl═ZnCl2+H2↑
65 73 136 2
x y z 0.2g
$\frac{65}{2}=\frac{x}{0.2g}$ x=6.5g
该合金中铜的质量分数为$\frac{10g-6.5g}{10g}×$100%=35%.
③$\frac{73}{2}=\frac{y}{0.2g}$ y=7.3g
所用盐酸中溶质的质量分数为$\frac{7.3g}{10g+10g+5g}×$100%=29.2%.
④$\frac{136}{2}=\frac{z}{0.2g}$ z=13.6g
完全反应时所得溶液的溶质的质量分数为$\frac{13.6g}{6.5g+10g+10g+5g-0.2g}$×100%≈43.5%.
答:(1)Cu-Zn;(2)①0.2;②35%;③所用盐酸中溶质的质量分数为29.2%;④完全反应时所得溶液的溶质的质量分数为43.5%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,细致地分析表格信息,从多组数据中筛选出对解题有帮助的数据是解这类题的关键.


科目:初中化学 来源: 题型:选择题
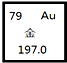
| A. | 核电荷数为276 | B. | 原子序数为118 | ||
| C. | 相对原子质量为197.0 | D. | 中子数为79 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 移动游码至2.4g刻度 | B. | 移动游码至2.2g刻度 | ||
| C. | 移动游码至1.2g刻度 | D. | 移动游码至1.1g刻度 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 方法 | 示例 |
| A | 实验法 | 用红磷做“测定空气中氧气含量”的实验 |
| B | 分类法 | 根据组成物质的元素种类,将纯净物分为单质和化合物 |
| C | 归纳法 | 水、二氧化碳是分子构成的,归纳出所有物质都是由分子构成的 |
| D | 对比法 | 用等体积的水和空气进行压缩,得出气体与液体微粒间的间隙大小关系 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的办法 |
| A | N2 | O2 | 通过足量的灼热铜网 |
| B | CO | CO2 | 通过足量的氢氧化钠溶液 |
| C | H2 | 水蒸气 | 通过盛有硫酸铜粉末的干燥管 |
| D | CO2 | CO | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 熔点:武德合金小于铅(铅为武德合金成分之一) | |
| B. | 硬度:黄铜大于铜 | |
| C. | 铁元素的质量分数:Fe2O3>FeO | |
| D. | 铜和铁生锈的难易:铜比铁难 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com