

| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
| 36.5 |
| 58.5 |
| 10g×7.3% |
| x |
| 1.17g |
| 20g+10g |
| 1.17g+y |
| 20g+10g+y |
| 36g |
| 136g |


 阶梯计算系列答案
阶梯计算系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
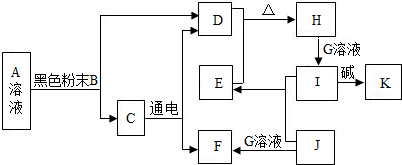
查看答案和解析>>
科目:初中化学 来源: 题型:
 中国筹划高铁“大棋局”,国人有望乘高铁2天到达美国.请回答下列问题:
中国筹划高铁“大棋局”,国人有望乘高铁2天到达美国.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
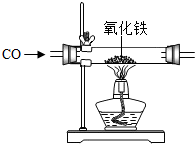 化学与人类生活生产息息相关,请用化学知识解答下列问题.
化学与人类生活生产息息相关,请用化学知识解答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:
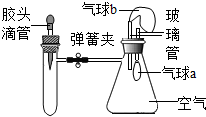 如图所示是某兴趣小组同学设计的趣味实验装置,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入液体,打开弹簧夹,能使气球a明显鼓起的是
如图所示是某兴趣小组同学设计的趣味实验装置,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入液体,打开弹簧夹,能使气球a明显鼓起的是| 序号 | 试管内物质 | 胶头滴管内物质 |
| A | 氢氧化钠固体 | 水 |
| B | 氯化钡溶液 | 稀硫酸 |
| C | 二氧化碳 | 氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
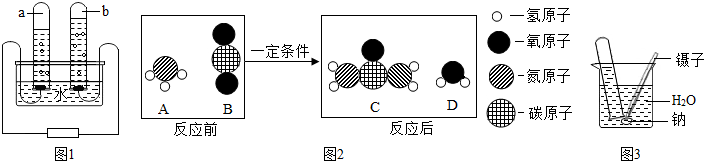
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com