
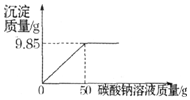
 李杨同学在某化工厂进行社会实践,技术员与李杨一起分析由氯 化钡和氯化钠组成的产品中氯化钡的质量分数.他们取 16.25g 固体样品,全部溶于 143.6mL 水中,向所得到的混合溶液中逐滴加入溶质质量分数为 10.6%的碳酸钠溶液,记录了如图 所示的曲线关系(水的密度为 1g/cm3).试计算:
李杨同学在某化工厂进行社会实践,技术员与李杨一起分析由氯 化钡和氯化钠组成的产品中氯化钡的质量分数.他们取 16.25g 固体样品,全部溶于 143.6mL 水中,向所得到的混合溶液中逐滴加入溶质质量分数为 10.6%的碳酸钠溶液,记录了如图 所示的曲线关系(水的密度为 1g/cm3).试计算:分析 (1)根据图象可知:曲线的折点所对应的碳酸钠溶液的质量即恰好完全反应时所消耗的质量;
(2)根据反应的化学方程式,利用恰好完全反应时消耗碳酸钠的质量或生成沉淀的质量,计算与碳酸钠发生反应的氯化钡的质量,由氯化钡质量与产品质量利用质量分数计算公式计算出产品中氯化钡的质量分数即可;
(3)恰好完全反应后过滤,所得滤液为氯化钠溶液,溶质氯化钠的质量为产品中氯化钠与反应生成氯化钠质量和,滤液的质量可利用质量守恒定律进行计算;由反应计算出生成氯化钠的质量后,利用溶质质量分数计算公式求出所得滤液中溶质氯化钠的质量分数.
解答 解:(1)根据曲线可知,当加入碳酸钠溶液50g时,恰好完全反应;故答案为:50;
(2)设样品中BaCl2的质量为x,生成NaCl的质量为y.
BaCl2+Na2CO3═BaCO3↓+2NaCl
208 106 117
x 50g×10.6% y
则 $\frac{208}{x}=\frac{106}{50g×10.6%}=\frac{117}{y}$,解得:x=10.4g,y=5.85g;
产品中氯化钡的质量分数=$\frac{10.4g}{16.25g}$×100%=64%;
(3)水的密度为1g/cm3,则143.6mL水的质量为143.6mL×1g/cm3=143.6g;
当氯化钡与碳酸钠恰好完全反应时.过滤后所得溶液的质量为:16.25g+143.6g+50g-9.85g=200g;
则溶液中溶质的质量分数为$\frac{5.85g+5.85g}{200g}$×l00%=5.85%
答:(2)产品中氯化钡的质量分数是64%;(3)当氯化钡与碳酸钠恰好完全反应时,过滤所得溶液中溶质的质量分数是5.85%.
点评 在对反应图象中曲线进行分析时,曲线的折点的意味着曲线所表示的反应在此时恰好完全反应.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:选择题
| A. | ③ | B. | ②③ | C. | ②④ | D. | ①② |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 温度高于t℃时,KCl的溶解度大于KNO3的溶解度 | |
| B. | 使KCl从溶液中结晶,多采用冷却热饱和溶液的方法 | |
| C. | 40℃时,KNO3饱和溶液的溶质质量分数为64% | |
| D. | 60℃的KNO3饱和溶液210g降温至40℃,能析出46g晶体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+ | |
| B. | 滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+ | |
| C. | 滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+ | |
| D. | 滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
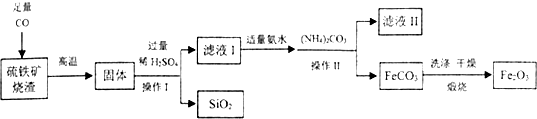
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
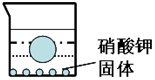 如图所示质量m克的小球悬浮在50℃硝酸钾溶液中,烧杯底部还留有一定量的硝酸钾固体.硝酸钾的溶解度随温度的变化如表所示.当温度下降时,请判断该小球的浮沉情况.并说明理由.
如图所示质量m克的小球悬浮在50℃硝酸钾溶液中,烧杯底部还留有一定量的硝酸钾固体.硝酸钾的溶解度随温度的变化如表所示.当温度下降时,请判断该小球的浮沉情况.并说明理由.| 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度(克) | 20.9 | 31.6 | 45.8 | 63.9 | 85.8 | 110 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
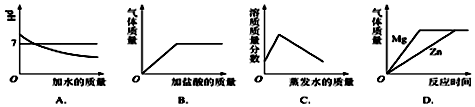
| A. | 向pH=12的石灰水中不断加水稀释 | |
| B. | 向碳酸钙固体中逐滴加入稀盐酸至过量 | |
| C. | 在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. | 将等质量的金属镁和锌分别和足量相同质量分数的稀硫酸混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com