
【题目】金属材料在生产和生活中有着广泛的应用。
(1)厨房中用铁锅炒菜是利用了铁的____性。
(2)铜能被加工成7微米厚的超薄铜箔,说明铜具有良好的____性,请写出一条保护金属资源的有效措施:____。
(3)已知铬金属(Cr)能与稀盐酸反应生成正二价铬的化合物,请写出反应的化学方程式____。
(4)燃烧产生的高温可用于冶炼金属。木炭在高温条件下可以还原氧化铜,该反应的化学方程式为____。
【答案】导热 延展 防止金属锈蚀;废旧金属有效回收利用;有计划,合理地开采矿物等 Cr+2HCl=CrCl2+H2↑ C+2CuO![]() 2Cu+CO2↑
2Cu+CO2↑
【解析】
根据金属的通性和用途分析解答;根据题干信息及金属的化学性质分析书写相关反应方程式;根据金属冶炼中的热还原法书写相关反应方程式。
(1)炒菜需要将菜加热,所以铁锅是利用了铁的导热性,故答案为:导热性;
(2)铜能被加工成超薄铜箔,说明铜具有良好的延展性;保护金属资源的有效措施有:防止金属锈蚀;废旧金属有效回收利用;有计划,合理地开采矿物等;故答案为:延展;防止金属锈蚀;废旧金属有效回收利用;有计划,合理地开采矿物等;
(3)根据题干信息知产物为CrCl2和H2,故答案为:Cr+2HCl=CrCl2+H2↑;
(4)木炭在高温条件下可以还原氧化铜,生成铜和二氧化碳,该反应的化学方程式为C+2CuO![]() 2Cu+CO2↑,故答案为:C+2CuO
2Cu+CO2↑,故答案为:C+2CuO![]() 2Cu+CO2↑。
2Cu+CO2↑。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:
【题目】如图为硫酸性质的知识归纳,下列表达不正确的是( )

A.若盐为BaCl2的溶液,则反应中有白色沉淀生成
B.若碱为NaOH的溶液,可以通过检测溶液中的pH变化情况,证明两者发生了中和反应
C.若金属氧化物为Fe2O3,可以利用硫酸与金属氧化物反应的这一性质,除去铁锈
D.若金属为Mg,则反应后的溶液呈浅绿色
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关反应:2CuO+C![]() 2Cu+CO2↑的说法中,正确的是( )
2Cu+CO2↑的说法中,正确的是( )
A.CuO 具有氧化性B.C 发生了还原反应
C.反应前后元素的化合价没有改变D.反应前后固体的质量不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学学习要建构若干基本观念,以下四类化学基本观念中认识正确的是(____)
A元素观:金刚石和石墨均是由碳元素组成的
B分类观:从结构上看,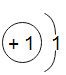 和
和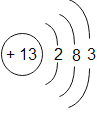 都属于金属元素
都属于金属元素
C变化观:一氧化碳可转化成二氧化碳,但二氧化碳不可转化成一氧化碳
D微粒观:水是由____________构成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧气是一种重要的物质,下图是三个与氧气有关的实验。请回答有关问题:
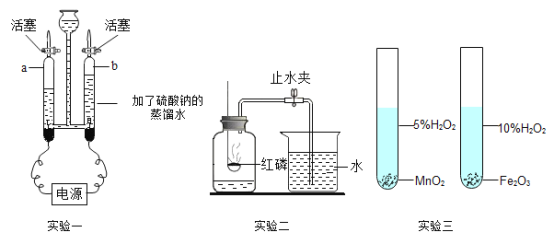
(1)实验一的实验目的是______________________;a管产生的气体是______________________;
(2)实验二中发生反应的化学方程式是______________________;打开止水夹后,看到的现象是______________________;
(3)有同学认为实验三不能对比二氧化锰与氧化铁对过氧化氢分解的催化效果。如果想要达到此目的,应改变实验方案,改变的方法是______________________;除了催化剂的种类,还能影响过氧化氢分解速率的因素有______________________和______________________等。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像不能正确反应其对应变化关系的是
A. 镁在空气中燃烧
镁在空气中燃烧
B. 向盛有少量硫酸溶液的烧杯中滴加一定质量的水
向盛有少量硫酸溶液的烧杯中滴加一定质量的水
C. 用等质量、等溶质质量分数的过氧化氢溶液在有无催化剂条件下制取氧气
用等质量、等溶质质量分数的过氧化氢溶液在有无催化剂条件下制取氧气
D.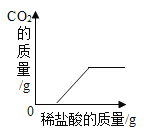 向盛有一定质量的NaOH和Na2CO3混合溶液的烧杯中滴加稀盐酸
向盛有一定质量的NaOH和Na2CO3混合溶液的烧杯中滴加稀盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
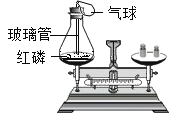
【题目】如图所示是通过红磷燃烧前后质量的测定验证质量守恒定律的实验,用红热的玻璃管引燃红磷,实验现象是:红磷燃烧,产生________,放出大量热。写出反应的化学方程式_______,实验中气球的作用除了使装置密闭之外,还可以防止______;红磷点燃前后,天平始终保持平衡,说明参加反应的各物质的质量总和______反应后生成的各物质的质量总和。实验时若取用红磷的量不足,对实验的结果______(选填“有”或“没有”影响)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面短文,回答相关问题。
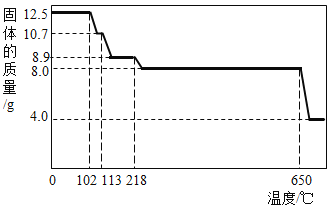
硫酸铜为白色或灰白色粉末,吸水性很强,吸水后反应生成蓝色的五水合硫酸铜[Cu(H2O)4]SO4·H2O或CuSO4·5H2O],其水溶液因水合铜离子的缘故而呈现出蓝色,故在实验室里无水硫酸铜常被用于检验水的存在。硫酸铜常见的形态为蓝色晶体,即五水合硫酸铜,俗称胆矾或蓝矾,它并不稳定,在加热的条件下,逐渐失去结晶水而变成硫酸铜粉末,给硫酸铜粉末继续加热至650℃高温,可分解为黑色氧化铜、二氧化硫及氧气 (如图为胆矾加热过程中固体质量与温度的关系)。
硫酸铜有广泛的应用,如:工业上可用于电镀、定氨催化剂,无水硫酸铜用作脱水剂和气体干燥剂;农业上可与熟石灰混合制农药波尔多液,用于杀菌剂;医疗上可用于检测贫血及作催吐剂。
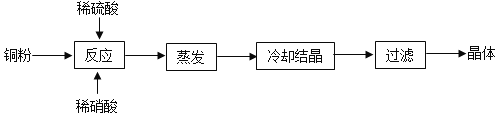
硫酸铜可以通过不同种方法制得,比如,下面的方法便可以制取硫酸铜。
硫酸铜属于重金属盐,有毒,对于人和动物都可因误食一定量而导致死亡,所以用量必须严格控制,若误食,应立即大量食用牛奶、鸡蛋清等富含蛋白质食品,或者使用EDTA钙钠盐解毒。
(1)硫酸铜溶液呈现为蓝色的原因是___。
(2)无水硫酸铜检验水存在的颜色变化是___。
(3)胆矾加热至650℃高温后,发生反应的化学方程式是___。
(4)在制备硫酸铜流程中,过滤后的溶液是___硫酸铜溶液(填“饱和”或“不饱和”)
(5)关于硫酸铜说法正确的是___。
A 五水合硫酸铜的相对分子质量是250
B 胆矾受热至102℃时失去了部分结晶水
C 无水硫酸铜可作气体干燥剂
D 硫酸铜的水溶液也称作为波尔多液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图,通过实验探究铁钉锈蚀的条件。下列说法不正确的是( )
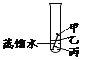
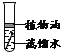
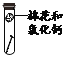
A. ①中甲、乙、丙三处比较,生锈最明显的地方是丙
B. ①②中使用煮沸的蒸馏水,目的是除去水中的氧气
C. ②中植物油的作用是隔绝空气,③中氯化钙的作用是作干燥剂
D. ①②③对比实验,得出结论:铁生锈的主要条件是与空气、水直接接触
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com