


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
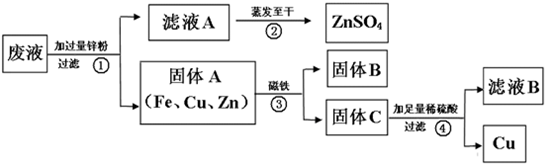
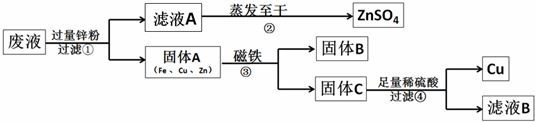
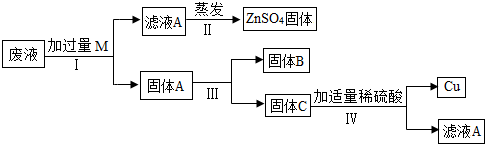
19、我市某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下: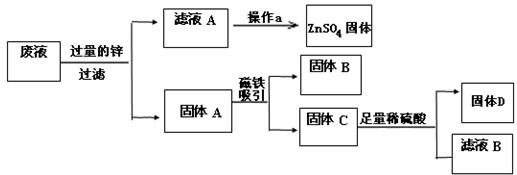 结合以上提纯过程,下列分析完全正确的是( )
|
查看答案和解析>>
科目:初中化学 来源: 题型:
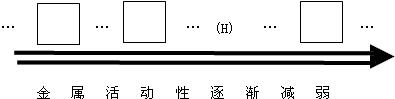
查看答案和解析>>
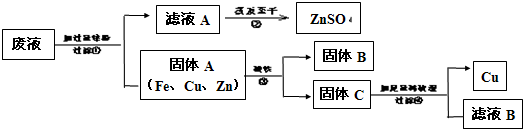
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com