
分析 锌与稀硫酸反应生成硫酸锌和氢气;由质量守恒定律,质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌和生成氯化锌的质量,进而计算出锌的质量分数和反应后溶液中溶质的质量分数.
解答 解:由质量守恒定律,生成氢气的质量为20g+200g-219.6g=0.4g.
设参加反应的锌的质量为x,生成氯化锌的质量为y,
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.4g
$\frac{65}{2}=\frac{x}{0.4g}$ x=13g
$\frac{161}{2}=\frac{y}{0.4g}$ y=32.2g
(1)铜锌合金中锌的纯度为$\frac{13g}{20g}×$100%=65%.
(2)反应后溶液中溶质的质量分数为$\frac{32.2g}{13g+200g-0.4g}$×100%≈15.1%.
答:(1)铜锌合金中锌的纯度为65%;(2)反应后溶液中溶质的质量分数为15.1%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
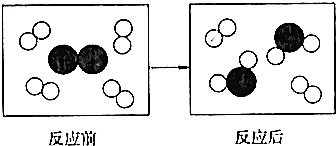
| A. | 4X+Y═X4Y | B. | X2+Y2=2XY | C. | 2X2+Y2═2X2Y | D. | 4X2+Y2═2X4Y |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com