

分析 根据题意可知,从海水中提取镁,应向海水中加入氢氧化钠,将氯化镁转换为氢氧化镁沉淀,通过过滤分离出氢氧化镁沉淀,再加入盐酸将氢氧化镁转化氯化镁,再通过电解熔融的氯化镁得到了镁.据此分析判断回答有关的难问题.
解答 解:由题意可知,从海水中提取镁,应向海水中加入氢氧化钠,将氯化镁转换为氢氧化镁沉淀,通过过滤分离出氢氧化镁沉淀,再加入盐酸将氢氧化镁转化氯化镁,再通过电解熔融的氯化镁得到了镁.
(1)由上述分析可知,试剂①的名称为氢氧化钠;分离得到Mg(OH)2沉淀和溶液的基本实验操作为过滤.
(2)由上述分析可知,试剂②为盐酸,溶质的化学式是:HCl,盐酸与Mg(OH)2发生了中和反应,化学反应的基本类型属于复分解反应.
(3)熔融的无水氯化镁通电分解生成了镁和氯气,反应的化学方程式:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
答案为:(1)氢氧化钠,过滤;(2)HCl,复分解反应(3)MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 利用流程图分析利用海水制备金属镁的流程,明确流程中所进行的操作和发生的反应,这是解决问题的基本方法.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
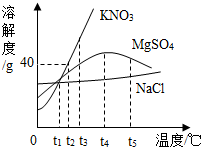 如图表示氯化钠、硝酸钾、硫酸镁三种物质的溶解度曲线.请回答:
如图表示氯化钠、硝酸钾、硫酸镁三种物质的溶解度曲线.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
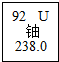 据光明日报2015年10月10日报道,我国科学家在自然界发现金属铀,属全球首次,如图是铀元素的相关信息,其中正确的是( )
据光明日报2015年10月10日报道,我国科学家在自然界发现金属铀,属全球首次,如图是铀元素的相关信息,其中正确的是( )| A. | 铀原子的中子数是92 | B. | 铀原子的质量为238.0g | ||
| C. | 铀原子的核外电子数是146 | D. | 铀原子的核电荷数(质子数)是92 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | A | B | C | D |
| 反应前质量/g | 19.7 | 8.7 | 31.6 | 0.4 |
| 反应后质量/g | 待测 | 17.4 | 0 | 3.6 |
| A. | 物质C一定是化合物,物质D可能是单质 | |
| B. | 反应后密闭容器中A的质量为19.7g | |
| C. | 反应过程中物质B与物质D变化的质量比为87:36 | |
| D. | 若物质A与物质C的相对分子质量之比为197:158,则反应中A与C的化学计量数(方程式中化学式前面的系数)之比为2:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学 实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
| 丙同学 实验 | 取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液 | 溶液变红红色 | 猜想(3)成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com