
【题目】下图为某氢氧化钠溶液与稀盐酸反应过程中的温度 及pH变化:有关分析错误的是( )
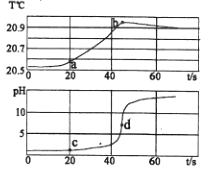
A. b点表示酸碱恰好中和
B. a点对应溶液的溶质为氯化钠和氯化氢
C. 该实验是将氢氧化钠溶液滴入稀盐酸中
D. c点到d点的曲线变化证明该反应放热
科目:初中化学 来源: 题型:
【题目】铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3和SiO2),不考虑其它杂质)制取金属铝的基本流程如下:

已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质;
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
(1)操作Ⅱ的名称是__________ 。所用的玻璃仪器有烧杯、漏斗、_________(填仪器名称)。
(2)滤液Ⅱ中溶质的用途之一是________________ 。
(3)电解熔融的Al2O3,除得到金属铝之外,还可得到的气体产物是______(填化学式)。
(4)工业上电解熔融的Al2O3时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低Al2O3的熔点,冰晶石在物质中的分类属于__________ (填字母)。
A.酸 B.碱 C.盐 D.氧化物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为核聚变的示意图,其中①②③表示三种原子。
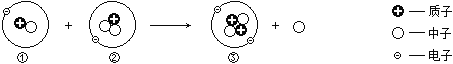
(1)①②③中属于同种元素的原子是_______,相对原子质量最大的是_____________。
(2)核聚变过程_________(填“有”或“没有”)生成新物质,_________(填“是”或“不是”)化学变化。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学符号填空:
(1)3个氧分子________________ (2)纯碱____________________
(3)2个铵根离子______________ (4)钠离子的原子结构示意图_____________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】浓硝酸易挥发,在光照条件下会发生如下反应:4HNO3![]() 4X↑+O2↑+2H2O,下列分析不正确的是
4X↑+O2↑+2H2O,下列分析不正确的是
A. X的化学式为NO2 B. HNO3中氮元素的化合价为+5价
C. 该反应为分解反应 D. 硝酸中氢和氧元素的质量比为4:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为鉴别NaCl溶液和Na2CO3溶液,甲、乙、丙三位同学设计方案如下:
甲 | 乙 | 丙 | |
实验操作 | 分别滴加酚酞试液
| 分别滴加______溶液
| 分别滴加BaCl2溶液
|
现象与结论 | 呈____色的是Na2CO3溶液,无色的是NaCl溶液 | 冒气泡的是Na2CO3溶液,无明显现象的是NaCl溶液 | 有____的Na2CO3溶液,无明显现象的是NaCl溶液 |
丙同学实验后将两只试管中的物质倒入洁净烧杯,静置后取上层清液,滴加稀硫酸观察到 ______,可知上层清液中含有BaCl2,为避免可溶性钡盐引起水体重金属污染,可向废液中加适量_______再排放。
A.碳酸钠溶液 B.硫酸钠溶液 C.硝酸银溶液 D.水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体(均不含结晶水)的溶解度曲线如图一所示,请回答。
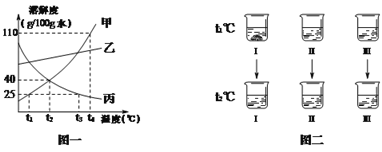
① t1℃时,固体甲的溶解度是______g/100g水。
② t2℃时,三种物质的饱和溶液中溶质质量分数的大小关系是______。
③固体甲中含有少量乙,为得到较纯净的固体甲,采用的结晶方法是______。
④t℃时,8 g固体丙放入20g水中完全溶解,t的最大取值范围是______ 。
⑤如图二所示,t1℃时将甲、乙、丙三种固体各a g分别放入盛有100 g水的烧杯中,充分溶解后只有烧杯Ⅰ中有固体剩余,升温至t2℃时,三个烧杯中均无固体。下列分析正确的是______。
A.烧杯Ⅰ、Ⅱ、Ⅲ中放入的固体依次为甲、乙、丙
B.t1℃时,烧杯Ⅱ、Ⅲ中的溶液都是不饱和溶液
C.t2℃时,三个烧杯中的溶液都是不饱和溶液
D.升温至t3℃时,有一个烧杯中出现晶体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学课外活动小组欲将含可溶性杂质和少量泥沙的CaCl2固体进行提纯,得到纯净的CaCl2固体。
(1)欲除去泥沙,得到较为纯净的CaCl2固体,应采取的实验步骤是:①________; ②_______;③ 蒸发。
(2)上述三步操作都要用到的玻璃仪器是:________。(填仪器名称)
(3)经实验证实所含可溶性杂质为NaCl,现欲去除该杂质,将进行下列操作。
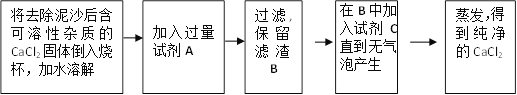
根据以上流程图,回答下列问题:
①请写出A、B、C三种物质的化学式:A___________ ;B___________ ;C___________
②写出加入过量试剂A的目的是_____________________
③写出加入过量试剂A的化学反应方程式:___________________________
④实验中称得滤渣的B的质量为5g,试计算蒸发后得到纯净CaCl2的质量是 _______ g。(精确到0.1 g)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】BaCl2是一种重金属盐,其水溶液具有很强的毒性。若误服了BaCl2溶液可立即服用MgSO4溶液解毒。为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液,不断加入MgSO4溶液,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,请回答:
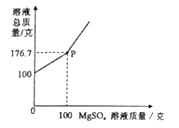
(1)P点时溶液中的溶质名称是 ;
(2)反应生成沉淀的最大质量为 克;
(3)求原BaCl2溶液的溶质质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com