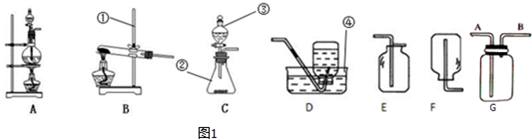
解答:解:(1)图1中标有数字的仪器的名称:①铁架台,②锥形瓶,③分液漏斗,④水槽;
(2)如果用高锰酸钾或氯酸钾制氧气就需要加热,如果用高锰酸钾制氧气就需要加热,试管口要放一团棉花,防止高锰酸钾粉末进入导管,堵塞导管,反应的方程式为:2KMnO
4K
2MnO
4+MnO
2+O
2↑;
(3)C装置适用于反应物是固体和液体混合制取氧气且不需要加热,所以用过氧化氢溶液和二氧化锰混合制取氧气,仪器②内盛放的液体是过氧化氢溶液,反应的化学方程式为:2H
2O
22H
2O+O
2↑;
(4)实验室中用稀盐酸和碳酸钙制取二氧化碳,反应物是固体和液体混合制取氧气且不需要加热,所以发生装置选择C,二氧化碳的密度大于空气的密度且能溶于水,所以用装置E收集,反应的化学方程式为:CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;二氧化碳不燃烧也不支持燃烧,所以验证二氧化碳收集满的方法是:将燃着的木条放到集气瓶口,如果木条熄灭,则证明二氧化碳已收集满;
(5)实验室常用金属锌粒和稀硫酸在常温下反应来制取氢气,反应物是固体和液体混合制取氧气且不需要加热,所以发生装置选择C,氢气的密度比空气小的气体且难溶于水,所以可用装置F或D;
(6)实验室用加热二氧化锰和浓盐酸混合物的方法制取氯气反应物是固体和液体且需要加热,所以发生装置选择A;
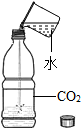
(7)二氧化碳的密度大于空气的密度,所以用图2装置时,气体应该从A导管通入;氧气的密度小于水的密度B,所以用图2装置时,如果用排水法收集氧气,应该先在该装置中装满水;气体应该从B导管通入;故填:装满水;
(8)关闭止水夹后,产生的气体不能出来,产生的压力使液体被压倒长颈漏斗中,固液分离,反应停止;
(9)图(Ⅲ)与图(Ⅱ)相比较,橡皮管的作用是平衡气压或使分液漏斗和试管内的压强一致,便于液体滴落下来;
(10)从表中实验数据可知双氧水浓度越大,分解得越快.
故答案为:
(1)①铁架台、②锥形瓶、③分液漏斗、④水槽;
(2)一团棉花、防止高锰酸钾粉末进入导管,堵塞导管、2KMnO
4K
2MnO
4+MnO
2+O
2↑;
(3)过氧化氢溶液、2H
2O
22H
2O+O
2↑;
(4)CE、CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O、用燃着的木条放在瓶口,如果木条熄灭则说明瓶内已收集满二氧化碳;
(5)C、F或D;
(6)A;
(7)装满水;
(8)液体被压回长颈漏斗中,固液分离,反应停止;
(9)平衡气压或使分液漏斗和试管内的压强一致,便于液体滴落下来;
(10)双氧水浓度越大.