
| 选项 | 物质(杂质) | 操作方式 |
| A | Cu(Fe) | 加足量稀硫酸,充分反应后过滤 |
| B | CO(CO2) | 将气体通入足量的澄清石灰水 |
| C | CO2(CO) | 点燃混合气体 |
| D | FeSO4溶液(CuSO4) | 加入足量铁屑,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、Fe能与稀硫酸反应生成硫酸亚铁和氢气,Cu不与稀硫酸反应,充分反应后过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
B、CO2能与足量的澄清石灰水反应生成碳酸钙沉淀和水,CO不与足量的澄清石灰水反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
C、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误.
D、足量铁屑能与CuSO4溶液反应生成硫酸亚铁溶液和铜,充分反应后过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
故选:C.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 琥珀酸亚铁由4个C原子、4H个原子、4个O原子、1个Fe原子构成 | |
| B. | 琥珀酸亚铁由4种元素组成 | |
| C. | 琥珀酸亚铁中C、O两种元素的质量比为1:1 | |
| D. | 琥珀酸亚铁的相对分子质量为172g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
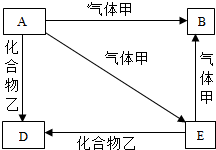 A、D是两种常见的固体,其中D为红色,B、E是两种常见的气体,其中E有剧毒,它们之间有如图转换关系.试推断:
A、D是两种常见的固体,其中D为红色,B、E是两种常见的气体,其中E有剧毒,它们之间有如图转换关系.试推断:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
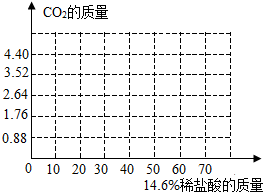 小明同学为了测定纯碱样品(碳酸钠与氯化钠的混合物)中碳酸钠的质量分数,取样品13.9g放入烧杯中,将60g质量分数为14.6%的稀盐酸分6次加入到该样品中,充分反应,化学方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,测得反应生成气体的质量(m)数据如下表所示:
小明同学为了测定纯碱样品(碳酸钠与氯化钠的混合物)中碳酸钠的质量分数,取样品13.9g放入烧杯中,将60g质量分数为14.6%的稀盐酸分6次加入到该样品中,充分反应,化学方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,测得反应生成气体的质量(m)数据如下表所示:| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
| 产生的气体质量(g) | 0.88 | 1.76 | 2.64 | 3.52 | 4.4 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com