
| A. | 汽油清洗油污-汽油起乳化作用 | |
| B. | 氢氧化钠用作干燥剂-氢氧化钠与水反应 | |
| C. | 稀有气体作保护气-稀有气体化学性质稳定 | |
| D. | 二氧化碳灭火-二氧化碳密度比空气小 |
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气是由多种单质和化合物组成的混合物 | |
| B. | 空气中含量较多且化学性质活泼的是氮气 | |
| C. | 呼吸、燃烧、炼钢、化工生产等都要用到氧气 | |
| D. | 在空气成分中,稀有气体所占比率虽然很小,但它们却是一类很重要的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
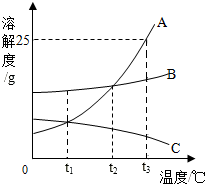 A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答:
A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 所含杂质 | 除杂试剂 | |
| A | 铁粉 | 铜粉 | 稀盐酸 |
| B | FeSO4溶液 | CuSO4 | 过量的铁粉 |
| C | NaCl | Na2CO3 | 稀H2SO4 |
| D | KCl | KNO3 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg(NO3)2、CuSO4、NaCl | B. | CaCl2、Na2CO3、AgNO3 | ||
| C. | K2SO4、NaNO3、NH4Cl | D. | BaCl2、Na2SO4、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单宁酸属于有机化合物 | |
| B. | 单宁酸是由 76 个碳元素、52 个氢元素和 46 个氧元素组成 | |
| C. | 单宁酸中碳、氧元素的质量比为 39:23 | |
| D. | 单宁酸中氧元素的质量分数最小 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
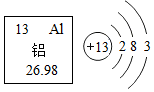 如图是铝元素在元素周期表中的信息和铝原子结构示意图.下列说法错误的是( )
如图是铝元素在元素周期表中的信息和铝原子结构示意图.下列说法错误的是( )| A. | 铝是金属元素 | |
| B. | 铝原子核外有3个电子层 | |
| C. | 铝原子的核电荷数为13 | |
| D. | 化学反应中,铝原子易失电子变成Al+3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com