
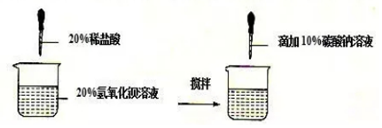
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 氢氧化钡溶液质量 | 171g | 171g | 171g |
| 滴加盐酸的质量 | 36.5g | 73g | 146g |
| 滴加碳酸钠溶液质量 | 212g | 212g | 212g |
分析 (1)加入盐酸与氢氧化钡反应生成氯化钡和水;
(2)根据氢氧化钡、盐酸的质量关系,反应是否恰好反应,再根据滴加碳酸钠溶液质量分析结束后所得溶液中溶质.
(3)根据氢氧化钡、盐酸的质量关系,反应是否恰好反应,再根据滴加碳酸钠溶液质量分析完全反应时生成白色沉淀的质量;
(4)根据(3)中分析判断.
(5)根据碳酸钠的质量计算氯化钠的质量,进一步计算所得不饱和溶液中溶质的质量分数.
(6)根据溶液稀释前后溶质的质量不变分析.
解答 解:(1)盐酸与氢氧化钡反应生成氯化钡和水,化学方程式为:2HCl+Ba(OH)2═BaCl2+2H2O;故填:2HCl+Ba(OH)2═BaCl2+2H2O;
(2)根据方程式2HCl+Ba(OH)2═BaCl2+2H2O;
73 171
可知36.5g20%的稀盐酸与171g20%氢氧化钡溶液质量反应时,氢氧化钡有85.5g剩余;
所以滴加碳酸钠溶液时碳酸钠与BaCl2和Ba(OH)2都反应,根据反应2HCl+Ba(OH)2═BaCl2+2H2O;BaCl2+Na2CO3═BaCO3↓+2NaCl
Ba(OH)2+Na2CO3═BaCO3↓+2NaOH可得关系式
Ba(OH)2~Na2CO3
171 106
171g×20% 212g×10%
可见碳酸钠与BaCl2和Ba(OH)2恰好反应,所得溶液中溶质为生成物NaCl和NaOH;故填:NaCl和NaOH;
(3)根据方程式2HCl+Ba(OH)2═BaCl2+2H2O;
73 171
可知73g20%的稀盐酸与171g20%氢氧化钡溶液质量恰好完全反应;
所以滴加碳酸钠溶液时碳酸钠与BaCl2反应,
根据反应2HCl+Ba(OH)2═BaCl2+2H2O;BaCl2+Na2CO3═BaCO3↓+2NaCl
可得关系式
Ba(OH)2~Na2CO3
171 106
171g×20% 212g×10%
可见碳酸钠与BaCl2和Ba(OH)2恰好反应,
参加反应的碳酸钠的质量为212g×10%=21.2g
设第二次实验生成白色沉淀质量为X:
BaCl2+Na2CO3═BaCO3↓+2NaCl
106 197
21.2g X
$\frac{106}{21.2g}=\frac{197}{X}$;
X=39.4g
故填:$\frac{106}{21.2g}=\frac{197}{X}$;
(4)由(3)分析可知第二次实验中每一步所加物质均恰好完全反应;
(5)设反应后生成氯化钠的质量为y
BaCl2+Na2CO3═BaCO3↓+2NaCl
106 117
21.2g y
$\frac{106}{21.2g}=\frac{117}{y}$
y=23.4g
若向第二次的溶液中加入51.4g水,则所得不饱和溶液中溶质的质量分数为$\frac{23.4g}{171g+73g+212g-39.4g+51.4g}$×100%=5%.
(6)三次实验中共使用稀盐酸质量为36.5g+73g+146g=255.5g
设需用36.5%的浓盐酸的质量为w
36.5%×w=255.5g×20%
w=140g
答:设需用36.5%的浓盐酸的质量为140g.
点评 这是一道常见的化学综合计算题.解题的关键在于弄清化学反应中反应物、生成物之间的关系,同时要弄清杂质在反应中存在于什么地方.第二问中关于反应后溶液中溶质的质量分数的计算,关键是要弄清反应后溶液是什么溶液.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 无需变动 | B. | 减少流量 | C. | 加大流量 | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | X | Y | Z | W |
| 反应前的质量/g | 10 | m | 8 | 7 |
| 反应后的质量/g | 2 | 3 | 30 | 25 |
| A. | m的数值为32 | |
| B. | 参加反应的X与Y的质量比为1:4 | |
| C. | 若W为水,则X或Y必定为酸或碱 | |
| D. | 若X为化合物,Y为单质,则Z和W中也一定有一种单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2% | B. | 4% | C. | 10% | D. | 19.6% |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 五个氢原子:5H | B. | 水中氧元素的化合价:H2$\stackrel{-2}{O}$ | ||
| C. | 两个钙离子:2Ca+2 | D. | 四个氨分子:4NH4 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
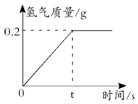 李明同学通过查阅资料得知钠与冷水可发生剧烈反应,并生成氢气和氢氧化钠.在一节实验课上,老师从实验室取了4.6g的钠与一盆质量为5kg的冷水,将钠放入水中后同学们观察到水中有气体产生,且生成的气体的质量与时间的关系如图所示,求:
李明同学通过查阅资料得知钠与冷水可发生剧烈反应,并生成氢气和氢氧化钠.在一节实验课上,老师从实验室取了4.6g的钠与一盆质量为5kg的冷水,将钠放入水中后同学们观察到水中有气体产生,且生成的气体的质量与时间的关系如图所示,求:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | O4是一种新的氧化物 | B. | O4、O3、O2都是单质 | ||
| C. | O4、O3、O2三者的性质相同 | D. | 由普通O2合成O4属于物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com