
| A. | 10mL酒精和10mL水混合后体积小于20mL,是因为分子变小了 | |
| B. | NH4NO3不能与熟石灰同时施用 | |
| C. | 富硒大米、低钠盐中的“硒”和“钠”指的是原子 | |
| D. | 中学生每天喝的牛奶是一种溶液 |
分析 A.根据分子的基本特征来分析;
B.根据铵态氮肥的化学性质进行分析;
C.食品、药品、营养品、矿泉水等物质中的“硒”“钠”等不是以单质、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.
D.根据牛奶溶液的概念来判断.
解答 解:A.10mL酒精和10mL水混合后体积小于20mL,因为分子之间有间隔,不是因为分子变小了.故解释错误;
B.铵态氮肥不能与碱性物质混合使用,否则会降低肥效,熟石灰是碱,因此NH4NO3不能与熟石灰混用,故正确;
C.富硒大米中的“硒”、低钠盐中的“钠”不是以单质、分子、原子等形式存在,这里所指的“硒”、“钠”是强调存在的元素,与具体形态无关.故错误;
D.牛奶不是溶液而是乳浊液,故错误.
故选B.
点评 此题把化学知识应用到生活生产实际当中,利用化学知识解答生活生产实际问题,此类型的考题是近几年中考常出现的题型.掌握基础知识,学会知识迁移应用,便能轻松解题.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:初中化学 来源: 题型:解答题
 某校课外活动小组探究金属铜与稀硝酸(HNO3)反应后生成了一氧化氮(NO)气体,设计如图所示实验装置(加热装置和固定装置均已略去).提示:图中K1、K2为止水夹(处于关闭状态),B中的注射器中含有一定量空气.
某校课外活动小组探究金属铜与稀硝酸(HNO3)反应后生成了一氧化氮(NO)气体,设计如图所示实验装置(加热装置和固定装置均已略去).提示:图中K1、K2为止水夹(处于关闭状态),B中的注射器中含有一定量空气.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金刚石和不锈钢都属于合金 | |
| B. | 碳酸氢铵(NH4 HCO3)和硝酸钾(KNO3)均属于复合肥料 | |
| C. | 水结冰后分子停止运动 | |
| D. | 风能、太阳能属于绿色能源 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
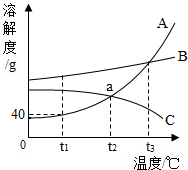 如图为A、B、C三种物质的溶解度曲线,据图回答:
如图为A、B、C三种物质的溶解度曲线,据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
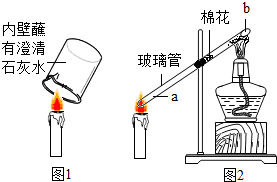 小红做蜡烛燃烧实验时,将内壁沾有澄清石灰水的烧杯罩在蜡烛火焰上(如图1),观察到澄清石灰水变浑浊,化学反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O.小芳根据溶解度相关知识提出,该实验不能证明蜡烛燃烧生成了二氧化碳气体,你认为原因是:氢氧化钙的溶解度随温度升高而减小;在不添加实验仪器和药品的情况下(不考虑水分蒸发),请设计一个实验验证蜡烛燃烧生成了二氧化碳气体:将变浑浊的石灰水冷却至室温,浑浊现象没有消失.
小红做蜡烛燃烧实验时,将内壁沾有澄清石灰水的烧杯罩在蜡烛火焰上(如图1),观察到澄清石灰水变浑浊,化学反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O.小芳根据溶解度相关知识提出,该实验不能证明蜡烛燃烧生成了二氧化碳气体,你认为原因是:氢氧化钙的溶解度随温度升高而减小;在不添加实验仪器和药品的情况下(不考虑水分蒸发),请设计一个实验验证蜡烛燃烧生成了二氧化碳气体:将变浑浊的石灰水冷却至室温,浑浊现象没有消失.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com