
【题目】氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:

(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是__(填名称)。
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是__。
(3)写出“电解槽“中发生反应的化学方程式__,流程中可以循环使用的物质有__(填化学式)。
(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 | 氢氧化钠含量 | 碳酸钠含量 |
优等品 | ≥99.0% | ≤0.5% |
一等品 | ≥98.5% | ≤0.8% |
合格品 | ≥98.0% | ≤1.0% |
①你认为碱样品中含有Na2CO3的原因是__,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是__。
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是__(不考虑其他杂质参加反应)。
【答案】玻璃棒除去氯化钠中的杂质氯化镁2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;NaOH部分氢氧化钠与二氧化碳反应生成了碳酸钠;bc一等品
2NaOH+Cl2↑+H2↑;NaOH部分氢氧化钠与二氧化碳反应生成了碳酸钠;bc一等品
【解析】
(1)溶解、过滤、蒸发等实验操作中都需要使用的仪器是玻璃棒;
(2)“精制”过程中加入NaOH可以与氯化镁反应生成氢氧化镁沉淀,可以除去氯化镁;
(3)“电解槽“中氯化钠化钠和水通电分解生成氢氧化钠、氯气和氢气,发生反应的化学方程式为2NaCl+2H2O通电2NaOH+Cl2↑+H2↑,流程中可以循环使用的物质是NaOH;
(4)①碱样品中含有Na2CO3的原因是因为氢氧化钠与二氧化碳反应生成碳酸钠,检验碱样品中是否含有Na2CO3,a.酚酞不能选,因为氢氧化钠和碳酸钠都是呈碱性的;b.稀盐酸能与碳酸钠反应产生气体,可以选用;c.澄清石灰水能与碳酸钠反应产生白色沉淀,可以选用,故选bc;
②由于碱样品中含碳酸钠、氯化钠,故根据碳酸钡计算碳酸钠的质量计算的结果不如计算氢氧化钠的质量准确,设氢氧化钠的质量为x
HCl+ NaOH═NaCl+H2O
36.5 40
365g×5% x
![]()
x=20g
氢氧化钠的质量分数为:![]() ≈98.5%
≈98.5%
该碱样品的等级是是一等品。


科目:初中化学 来源: 题型:
【题目】(5分)小华按右图配方自做一瓶清凉甘甜的汽水。
根据图中信息回答:

(1)小苏打中含有的金属元素的名称是 。
(2)打开汽水瓶盖产生气体的主要成分是 ,
该气体由柠檬酸与 反应生成。
(3)白糖的主要成分是C12H22O11,C12H22O11属于 ,(填“有机物”或“无机物”),其中 碳、氢、氧三种元素的质量比是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
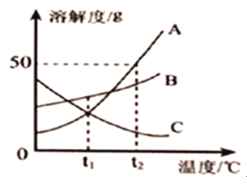
【题目】A、B、C三种固体物质的溶解度曲线如图所示。请回答下列问题。
(1)t1℃时,溶解度相同的物质是_____。
(2)若保持溶液质量不变,将C的饱和溶液变为不饱液的方法是_____。
(3)t2℃时,把50gA放入50g水中,所得溶液中溶质和溶液的质量比为_____(填最简整数比)。
(4)将t2℃时等质量的A、B、C三种物质的饱和溶液,降温度温至t1℃时所得溶液中溶剂质量由大到小顺序为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用如图所示装置进行如下实验探究。
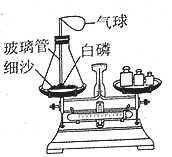
在锥形瓶中放入一小粒白磷,塞好瓶塞后玻璃管下端刚好能与白磷接触,将整套装置放在托盘天平上调节至平衡,取下橡皮塞,将玻璃管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
(1)实验时,气球的变化是__。
(2)根据白磷引燃前后的变化,可知燃烧的条件是__;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是__。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针__(填“向左偏”“向右偏”或“指向中间”)
(4)白磷(P4)燃烧生成P2O5,写出该反应的化学方程式:__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】复印用的墨粉中含有Fe3O4粉末。制备Fe3O4的主要流程如下。
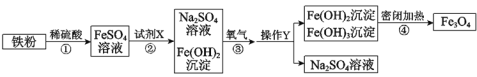
(1)①中发生反应的化学方程式为______。
(2)试剂X为______。
(3)操作Y为______。
(4)流程③反应前后,各物质中元素化合价发生改变的是______(填元素符号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现在有两个化学反应,一个反应的产物是另一个反应的反应物,且一个反应的反应物是另一个反应的产物。如果把其中一个反应叫做“正反应”,那么另一个反应就是这个反应的“逆反应”。在一定条件下用普通铁粉和水蒸气反应,可以得到可以被磁铁吸引的铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和20%的盐酸溶液,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。填写下列空白:
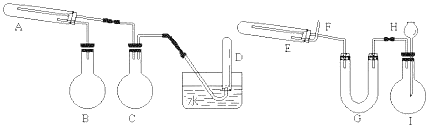
(1)实验进行时试管A中应加入的试剂是_____;烧瓶B的作用是_____;烧瓶C的作用是_____;在试管D中收集得到的是_____。
(2)实验时,U型管G中应加入的试剂是_____;长颈漏斗H中应加入_______。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)___。
(4)试管E中发生反应的化学方程式是___________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并按要求填空。
(1)工业上用一氧化碳和赤铁矿(主要成分是三氧化二铁)在高温下炼铁:__________。
(2)生石灰作为干燥剂: ____________________,该反应属于_________ (选填“放或吸热”)。
(3)用氢氧化钠溶液吸收少量二氧化硫气体:___________________________________。
(4)用稀硫酸除去铁锈:_____________________,反应后所得溶液的颜色为_________色。
(5)硫酸铵固体和氢氧化钙固体混合研磨:___________,该反应的基本反应类型是_______。
(6)生成沉淀的中和反应:_________________________________,恰好完全反应后液体的导电性比反应前的______ (选填“增强”、“减弱”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形。下表为元素周期表的部分示意图,请利用下表回答相关问题。
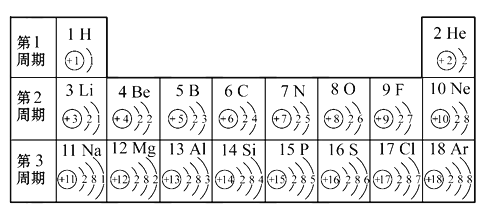
(1)一个水分子共有________个质子,________个原子核。
(2)我发现如下规律:
①化学反应中,第Ⅰ纵行的元素比较容易________电子(除H外);第Ⅵ纵行的元素比较容易________电子,都通常达到8个电子的稳定结构。可见元素的化学性质主要决定于原子的________数。
②从原子结构方面看:同一横行的元素的原子具有相同的________数;同一纵行的元素的原子具有相同的________数。
③核电荷数为19的元素的原子最外层上的电子数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com