
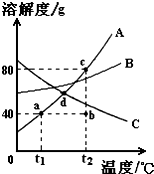
 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答:分析 (1)运用t1℃A的溶解度是40g分析.
(2)运用A的溶解度随温度的升高而增大、甲的饱和溶液会变为不饱和溶液、t2℃时甲的溶解度为80g、溶解度越大饱和溶液溶质质量分数越大分析.
(3)运用C的溶解度随温度的降低而增大,AB的溶解度都随温度的降低而减小,及溶解度和溶质的质量分数之间的关系分析.
解答 解:(1)对A物质来说,a点的意义是:t1℃时,A物质的溶解度为40g;
(2)t1℃时A的溶解度是40g,即100g水中最多溶解的A是40g,形成饱和溶液140g,所以t1℃140gA的饱和溶液相当于曲线上的a点,升温至t2℃时,可用图上的b点表示,因为升温过程中A的溶解度变大,溶质的质量不变,此时溶液是不饱和状态,然后再加入A物质40g,则溶液中的溶质是80g,相当于100g水中最多溶解了80g的A,可用曲线上的c点表示,因为又达到了饱和;t2℃时A、B、C三种物质溶解度由大到小的顺序是A>B>C,据饱和时质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%可知:溶解度大则溶质的质量分数大,所以t2℃时A、B、C三种物质饱和溶液的质量分数由大到小的顺序是A>B>C;
(3)若将d点温度下A、B、C三种物质的饱和溶液降温至t1℃,没有晶体析出的是C物质,因为C的溶解度随温度的升高而减少;在t1℃时,AB溶解度减小,析出晶体,此时B的溶解度大于降温前C的溶解度大于A的溶解度,所以此时三种溶液的溶质质量分数由大到小的顺序是B>C>A;
故答案为:
(1)t1℃时,A物质的溶解度为40g;(2)b;不饱和;c;A>B>C;(3)C;B>C>A.
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了饱和溶液中溶解度大则溶质质量分数大的相关知识,要细心分析解答.


 天天练口算系列答案
天天练口算系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧化钙+水→氢氧化钙 | B. | 铁+氧气$\stackrel{点燃}{→}$四氧化三铁 | ||
| C. | 过氧化氢$\stackrel{二氧化锰}{→}$水+氧气 | D. | 蜡烛+氧气$\stackrel{点燃}{→}$氧化碳+水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
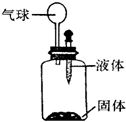 默默同学在一个趣味实验活动中发现(如图):下列四组药品都能让装置上的气球鼓起来.
默默同学在一个趣味实验活动中发现(如图):下列四组药品都能让装置上的气球鼓起来.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
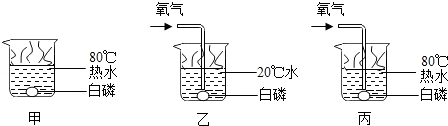
| A. | 白磷能够燃烧的是实验是丙 | |
| B. | 对比实验乙和丙可以得到的结论是:可燃物燃烧温度需要达到着火点 | |
| C. | 对比实验甲和乙可以得到的结论是:可燃物燃烧需要与氧气接触 | |
| D. | 通过研究燃烧的条件可知:燃烧的三个条件缺一不可 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在流感发生时,为预防传染,可将教室的门窗关闭,用食醋熏蒸 | |
| B. | 给胃酸过多的人服用含Al(OH)3的药品 | |
| C. | 做胃X光透视的人需口服含硫酸钡的“钡餐”,现将其改为口服碳酸钡 | |
| D. | 预防佝偻病,可服用含钙的葡萄糖酸钙片 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
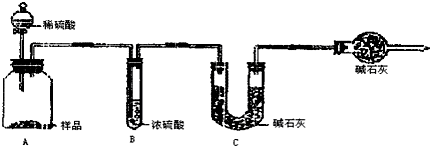
| 分析与计算 | 计算样品中碳酸钠的质量分数 | 对实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲组 | 79.5% | 失败 | 加入的稀硫酸没有完全将碳酸钠反应掉,且没有冷却至室温,部分二氧化碳存在于装置内,没有被C装置内的碱石灰所吸收,造成测量结果偏小 |
| 乙组 | 99.6% | 成功 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com