
富含淀粉的谷物、甘薯等可以酿酒.在酿酒过程中淀粉在酶的作用下转化为葡萄糖,葡萄糖发酵为酒精.香甜的酒酿就是利用该原理.用酒曲酶(俗称酒药)制作的.家庭一般制作酒酿的简单流程图如下:(注:有机反应化学方程式可用箭号表示) 
(1)配平化学方程式:(C6H10O5)n(淀粉)+ H2O nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
(2)如温度、水分等因素控制不当,易导致乳酸量过多而味偏酸,请完成该反应的化学方程式:C6H12O6 2 (乳酸).
2 (乳酸).
(3)成熟的酒酿放置时间越长酒味越浓,因为更多的葡萄糖在酒化酶作用下发酵分解为酒精(C2H5OH )和二氧化碳,写出该反应的化学方程式 .
(4)若用1kg大米酿米酒,假设其中有0.81kg的淀粉全部转化为酒精,则理论上可酿制含酒精质量分数为10%的米酒 kg,(提示:由淀粉转化为酒精的关系式为(C6H10O5)n~2nC2H5OH).
解:(1)只要在水分子前面加上n就平了;
(2)反应物中含有6个碳,12个氢,6个氧,生成物中也必须有这些,又因为生成物前面的系数是2,所以化学式中含有3个碳,6个氢,3个氧就行,所以化学式为C3H6O3;
(3)根据葡萄糖在酒化酶作用下发酵分解为酒精(C2H5OH )和二氧化碳,可知反应的反应物是C6H12O6;生成物是C2H5OH和CO2 用观察法配平即可;
(4)设0.81kg的淀粉生成酒精质量为X则:
(C6H10O5)n~2nC2H5OH
162n 92n
0.81kg X
根据: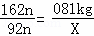 解得X=0.46kg,所以可酿制含酒精质量分数为10%的米酒质量为:
解得X=0.46kg,所以可酿制含酒精质量分数为10%的米酒质量为: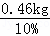 =4.6kg.
=4.6kg.
故答案为:(1)n;(2)C3H6O3;(3)C6H12O6 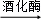 2C2H5OH+2CO2↑;(4)4.6
2C2H5OH+2CO2↑;(4)4.6


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
在实验室的开放日里,几个小组的同学来到实验桌前,桌上都摆放有下列仪器(药品省略):

⑴ 第一组组长让大家完成的第一个任务是写出仪器的名称,某同学完成任务的情况如上图所示,其中名称有错误的是 (填字母)。
⑵ 第一组准备用加热高锰酸钾的方法制取氧气,写出该反应的的符号表达式:
,他们选用的仪器为 (填字母),此组同学还问老师要了一团棉花,棉花的作用是:  。
。
 ⑶ 第二组同学选择a、b、d、g组合制取氧气,所用的气体收集方法叫做 ,写出该反应的符号表达式: ,检验氧气是否集满的方法是 。
⑶ 第二组同学选择a、b、d、g组合制取氧气,所用的气体收集方法叫做 ,写出该反应的符号表达式: ,检验氧气是否集满的方法是 。
⑷ 第二组同学接着又做了如右图的实验——寻找过氧化氢
分解的新催化剂。白色点滴板是带有空穴的白色瓷板,可用
作微型化学反应。在将一定量的红砖粉、硫酸铜溶液……分
别加入点滴板中,再分别滴入过氧化氢溶液(如图所示),
观察到过氧化氢溶液产生气泡的速率加快。据此现象得出
结论:红砖粉、硫酸铜溶液等也能作过氧化氢分解的催化剂。
小红认为不正确,理由一:未探究它们的质量是否不变;理由二: 
。白色点滴板作为反应容器的优点有 。
查看答案和解析>>
科目:初中化学 来源: 题型:
某补钙药品的部分说明书如下图所示。若人体对该药品中钙元素的平均吸收率为40%,按照说明书服用,每天实际被人体吸收的钙元素质量是
|
A.0.60 g B.0.48 g C.0.24g D.1.20 g
查看答案和解析>>
科目:初中化学 来源: 题型:
某兴趣小组为验证质量守恒定律,做 了镁条在空气中燃烧的实验。
了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 ▲ 。
(2)小 明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 ▲ (“同意”或“不同意”)小明的观点,因为 ▲
明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 ▲ (“同意”或“不同意”)小明的观点,因为 ▲  。
。
 (3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
(3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
| 实验操作 | 实验现象及结论[ |
| ▲ | ▲ |
(4)为了证明镁可在氮气中燃烧生成氮化镁,小红又设计了如下方案进行验证。
 步骤①:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞
步骤①:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞
等装配成如图所示的装置;另准备一只有一根铜丝穿过的橡皮塞,铜丝末
端固定一根镁条。
步骤②:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,观察
到广口瓶内水面上升的体积约占瓶内水面原上方空间的 ▲ 左右。
步骤③:往水槽中加水使广口瓶内外水面相平;点燃镁条,迅速更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量;待冷却后广口瓶内水位继续上升。
A.步骤②的目的是 ▲ 。写出红磷在氧气中燃烧的化学方程式 ▲
B.在步骤③“待冷却后广口瓶内水位继续上升”是由于瓶内气压 ▲ (选填“大于” “小于”或“等于”)外界气压
C.写出镁在氮气中燃烧生成氮化镁的化学方程式 ▲
【反思与交流】
(5)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却大于Mg3N2。请给出合理的解释 ▲ 。
▲ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
据中国室内装饰协会调查,甲醛污染大部分是由板材产生,家庭装修中使用的夹芯板、地板、家具等都可能释放出甲醛.我国的国家标准检测:“El级板材相当于甲醛释放量为1.5mg/L;E0级板材的甲醛释放量为0.5mg/L.”E1级与E0级最大的区别就是甲醛的释放量,El级比E0级释放甲醛量多五分之一.目前,化学家已能从马铃薯中提取植物胶做板材的黏合剂,有效地减少了甲醛的排放.
试根据上述资料填空.(1)已知甲醛的结构式 ,则其化学式为 ,其碳、氢和氧元索的最简质量比为,其含氧元素的质量分数等于 .
,则其化学式为 ,其碳、氢和氧元索的最简质量比为,其含氧元素的质量分数等于 .
(2)资料中加点信息有误,实际上El级比E0级释放甲醛量多了 倍.
查看答案和解析>>
科目:初中化学 来源: 题型:
如图所示检查装置的气密性,用手紧握试管,水中的导管口有气泡冒出的主要原因是( )
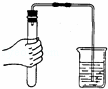
A.分子间隔变大了 B.分子体积变大了
C.分子质量变大了 D.分子个数变多了
查看答案和解析>>
科目:初中化学 来源: 题型:
人体缺碘会引起甲状腺肿大,幼儿缺碘影响生长发育,造成思维迟钝.结合图中信息判断,下列叙述正确的是( )
A.碘原子的质量 是126.9g
是126.9g
B.碘离子(I﹣ )的核外电子数为54
)的核外电子数为54
C.碘是人体必需的微量元素,摄入越多越好
D.碘原子核外有5个电子层,参加化学反应时易失去最外层电子
查看答案和解析>>
科目:初中化学 来源: 题型:
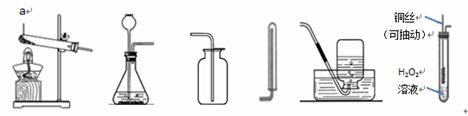 根据下列装置图,回答有关问题:
根据下列装置图,回答有关问题:
A B C D E F
(1)图中标有a的仪器名称是 。
(2)实验室用高锰酸钾制取氧气,应选用的发生装置是 (填字母),以高锰酸钾为试
剂利用此装置制取氧气时,还要做的改进是 ,其作用是 。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气的符号表达式为 ,若要制取并收集一瓶较干燥的氧气,应选用的装置组合为 (填字母),检验氧气是否收集满的方法为  。
。
|
根洁净的铜丝,实验前先将其绕成螺旋状,然后将其灼烧(Cu+O2→CuO)。改进后的发生装置如图F所示(己略去夹持装置)。
①铜丝绕成螺旋状的作用是 (填字母)。
A.收集到更多的02 B.加快反应速率 C.没有影响
②与装置B比较,改进后装置的优点是 。
(5)氨气是一种无色、有强烈刺激性臭味的气体,极易溶于水,溶于水形成氨水。实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气。某兴趣小组的同学设计如图G~J所示装置对氨气的制取、性质进行探究。

①装置I中的现象是__________________________。
②根据氨气的性质,J处应选择的最佳收集装置为_________(填“K”、“L”或“M”)。
③装置H的作用是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com