
分析 根据已有的知识结合反应化学方程式的书写方法解答,根据质量守恒定律化学反应前后元素的质量不变解答.
解答 解:(1)根据黄铁矿可硫铁矿的额化学式可以看出,硫铁矿中铁元素的含量高,故填:硫铁,FeS中Fe元素质量分数高于FeS2.
(2)二硫化亚铁能与氧气高温反应生成氧化铁和二氧化硫,二硫化亚铁中硫元素的化合价是-1价,在二氧化硫中硫元素的化合价是+4价,故填:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,由-1变为+4.
(3)设需要黄铁矿的质量为x
100t×98%×$\frac{32}{98}$=x×80%×$\frac{32×2}{56+32×2}$
x=75t
故填:75.
点评 本题考查的是炼铁的原理以及质量守恒定律的应用,完成此题,可以依据已有的知识进行.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:多选题
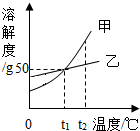 如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是( )
如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是( )| A. | t1℃时,甲、乙两种物质的溶解度都是50g | |
| B. | t2℃时,在两种饱和溶液中,溶质的质量甲一定大于乙 | |
| C. | t2℃时,将甲的饱和溶液降温至t1℃,其溶质的质量分数减小 | |
| D. | t1℃时,将30g甲放到50g水中,所得溶液的溶质质量分数为37.5% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钴难溶于水 | B. | 钴与金属铜的化学性质相同 | ||
| C. | 氢氧化钴的化学性质稳定 | D. | 氢氧化钴可用于干燥氯化氢气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 肥皂水可以区别硬水和软水 | |
| B. | 计算机房失火只能用泡沫灭火器灭火 | |
| C. | 风力发电可以减少对环境的污染 | |
| D. | 不能将固体废弃物扔到深山老林中 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 所含元素种类相同 | B. | 都含有氢气 | ||
| C. | 两种物质的化学性质不同 | D. | 硫元素的化合价不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | -3 | B. | +3 | C. | +1 | D. | +5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
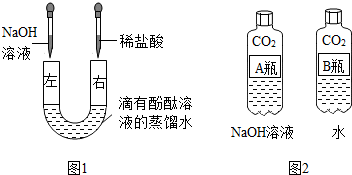
| 实验步骤 | 实验现象 | 结论 |
| 取图2实验中A瓶反应后所得的溶液少许于试管中,再向试管中滴加稀盐酸溶液 | 有气泡产生 | 验证了二氧化碳和氢氧化钠溶液发生了反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com