
| ||
| 1800 |
| 60 |
| ||
| 16 |
| 44 |
| 30aKg |
| x |
| ||


科目:初中化学 来源: 题型:
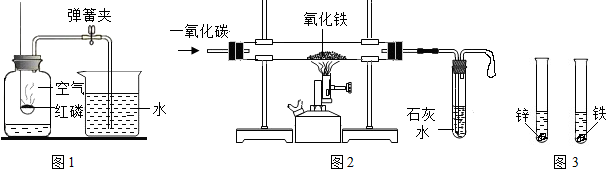
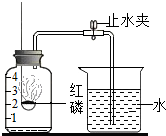 已知空气的主要成分是氮气和氧气.某课外活动小组设计了测定空气中氧气含量的实验:在燃烧匙内盛过量红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温后,再打开止水夹.实验装置如图所示
已知空气的主要成分是氮气和氧气.某课外活动小组设计了测定空气中氧气含量的实验:在燃烧匙内盛过量红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温后,再打开止水夹.实验装置如图所示
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
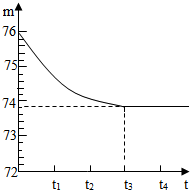 山东省汶上县白石镇山区拥有丰富的大理石矿产资源.今有坛山上的大理石样品,其中只含二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体).白石镇中学的同学们想测定该样品中碳酸钙的质量分数,他们选取了一块大理石样品,将其敲打粉碎后,称出6g放入烧杯内(烧杯质量为20g).然后加入50g某一定溶质质量分数的稀盐酸,用玻璃棒搅拌至不再产生气泡为止.反应所需时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示.请完成下列问题:
山东省汶上县白石镇山区拥有丰富的大理石矿产资源.今有坛山上的大理石样品,其中只含二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体).白石镇中学的同学们想测定该样品中碳酸钙的质量分数,他们选取了一块大理石样品,将其敲打粉碎后,称出6g放入烧杯内(烧杯质量为20g).然后加入50g某一定溶质质量分数的稀盐酸,用玻璃棒搅拌至不再产生气泡为止.反应所需时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示.请完成下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
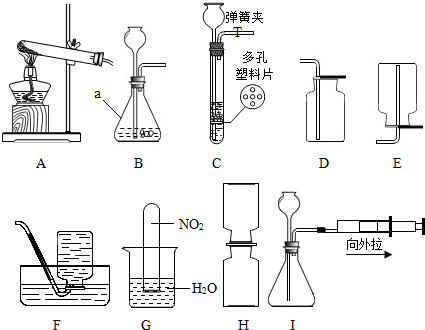 实验室拟用下列装置来制取气体:
实验室拟用下列装置来制取气体:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com