
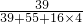 ×100%=24.7%,高锰酸钾中钾元素的质量为31.6g×24.7%=7.8g,剩余固体的质量为
×100%=24.7%,高锰酸钾中钾元素的质量为31.6g×24.7%=7.8g,剩余固体的质量为 =31.2g,生成的氧气的质量为31.6g-31.2g=0.4g,设生成的二氧化锰的质量为x
=31.2g,生成的氧气的质量为31.6g-31.2g=0.4g,设生成的二氧化锰的质量为x K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ =
=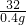
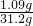 ×100%=3.5%.
×100%=3.5%.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com