
【题目】如图1是以石灰石为原料制备高纯超细碳酸钙的工艺流程图:
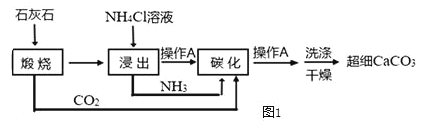
(1)流程中操作A的名称_____。实验室里该操作用到的玻璃仪器有烧杯、_____和_____。
(2)主要反应原理:
①“煅烧”步骤:主要反应的化学方程式为_____,反应基本类型为_____反应。
②“浸出”步骤:CaO+2NH4Cl=CaCl2+H2O+2NH3↑。
③“碳化”步骤:CO2+2NH3+H2O+CaCl2=CaCO3↓+2 NH4Cl。
(3)煅烧石灰石得到的固体中,除含CaO外,还含有少量MgO、FeO等杂质,在“浸出”过程为保证铁、镁等杂质不被浸出,需要适当提高溶液的pH.根据反应②计算出的钙铵比(参加反应的氧化钙和氯化铵的质量比)为_____,而实际流程中最佳钙铵比要稍高于这一比值,原因是_____。
(4)用上述流程可循环使用的物质除了H2O、CO2和NH3之外,还有_____。
(5)实验室在如图2装置中模拟上述流程制备高纯超细碳酸钙:
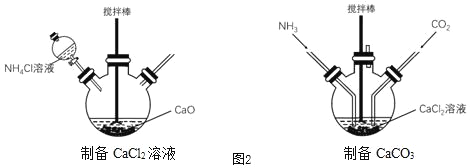
①搅拌的作用是_____。
②制备CaCl2溶液时需要对装置加热,主要作用是_____。
A 加快反应速率 B 促进氨气逸出
③已知在常温和一个标准大气压下,CO2和NH3在100g水中分别能溶解0.169g和52.9g。制备CaCO3时应先通入氨气后通入二氧化碳,理由是_____。
④浸取一步中NH4Cl溶液的溶质质量分数直接影响着生成CaCl2溶液溶质质量分数。已知0﹣100℃时NH4Cl的溶解度如下表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 |
如果用200g 80℃时NH4Cl的饱和溶液与纯氧化钙恰好完全反应,计算充分反应后得到CaCl2的质量_____。(写出计算过程,保留一位小数。)
【答案】过滤 漏斗 玻璃棒 CaCO3![]() CaO+CO2↑ 分解 56:107 控制为碱性环境 NH4Cl 加速反应 AB 增加二氧化碳的溶解和反应能力 82.2g
CaO+CO2↑ 分解 56:107 控制为碱性环境 NH4Cl 加速反应 AB 增加二氧化碳的溶解和反应能力 82.2g
【解析】
(1)流程中操作A实现了固体和液体分离,为过滤。实验室里该操作用到的玻璃仪器有烧杯、漏斗和玻璃棒;
(2)①“煅烧”步骤:是碳酸钙在高温下分解为氧化钙和二氧化碳,对应的化学方程式为 CaCO3![]() CaO+CO2↑,该反应是由一种生成两种物质,属于分解反应;
CaO+CO2↑,该反应是由一种生成两种物质,属于分解反应;
(3)煅烧石灰石得到的固体中,除含CaO外,还含有少量MgO、FeO等杂质,在“浸出”过程为保证铁、镁等杂质不被浸出,MgO、FeO能与酸性物质反应,需要适当提高溶液的pH,根据反应②计算出的钙铵比(参加反应的氧化钙和氯化铵的质量比)![]() 即钙铵比为 56:107,实际流程中最佳钙铵比要稍高于这一比值,原因是控制为碱性环境;
即钙铵比为 56:107,实际流程中最佳钙铵比要稍高于这一比值,原因是控制为碱性环境;
(4)NH4Cl在“浸出”步骤中是反应的反应物,在“碳化”步骤中是反应的生成物。在用上述流程可循环使用的物质除了H2O、CO2和NH3之外,还有 NH4Cl;
(5)①搅拌的作用是加速反应;
②制备CaCl2溶液时需要对装置加热,目的加快反应速率和促进氨气逸出。故选AB;
③一个标准大气压下,CO2和NH3在100g水中分别能溶解0.169g和52.9g。制备CaCO3时应先通入氨气后通入二氧化碳,理由是增加二氧化碳的溶解和反应能力;
④如果用200g 80℃时NH4Cl的饱和溶液中氯化铵的质量=![]() ;
;
设:充分反应后得到CaCl2的质量为x。
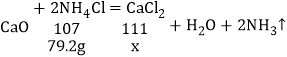
![]() x=82.2g。
x=82.2g。


科目:初中化学 来源: 题型:
【题目】小刚和小敏在探究氢氧化钠性质实验结束后,没有将氢氧化钠固体试剂瓶塞盖好。这样一瓶敞口放置的氢氧化钠固体,激发了同学们的探究欲望。
(提出问题)这瓶氢氧化钠固体是否变质?
氢氧化钠露置在空气中变质的原因是_____________________________(用化学方程式表示)
(提出猜想)
猜想一:没有变质;
猜想二:部分变质;
猜想三:全部变质。
(实验探究)小刚和小敏设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质。小敏认为小刚的结论是错误的,理由是___________________________________。
于是小敏进行了如下实验:
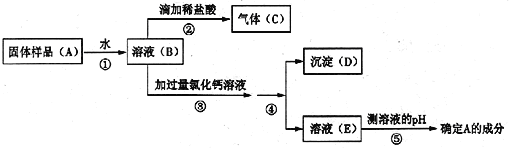
(1)上述实验操作④的名称_______________,其中玻璃棒的作用________________。
(2)步骤③中加过量氯化钙溶液的目的是___________________________________。
(3)步骤⑤中,小敏用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断猜想二是正确的。对他的操作方法、测量结果及结论的评价,正确的是________。
A 方法正确,结果正确,且结论正确
B 方法正确,结果正确,结论不正确
C 方法不正确,结果偏大,但结论正确
D 方法不正确,结果偏小,但结论正确
(交流反思)
(1)下列物质能替代小敏实验中CaCl2溶液的是____________(填序号)。
①BaCl2溶液 ②Ca(NO3)2溶液 ③Ca(OH) 2溶液 ④Ba(OH)2 溶液
(2)在实验室里氢氧化钠需要密封保存。药品密封保存的原因很多,请你写出浓硫酸需要密封保存的原因____________________________________。
(3)小红对上述固体中Na2CO3的含量产生兴趣,配置了100g溶液进行实验,测定Na2CO3的质量分数。取样,向溶液中逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示:

请回答下列问题:
①反应生成的气体质量为________g;
②该溶液中Na2CO3的质量分数。___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】框图中A是人体胃液中含有的成分,B用于改良酸性土壤,G是铁锈的主要成分(Fe2O3·xH2O),E、F、I为无色气体。根据图示回答下列问题。
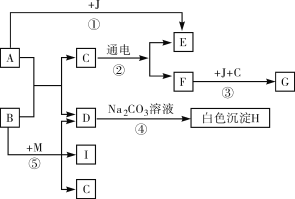
(1)写出有关物质的化学式:B_____,C_____。
(2)写出反应④的化学方程式_____。
(3)日常生活中为了阻止反应③发生,通常采取的措施是_____(写一条)。
(4)要使反应⑤能够发生,需要反应物B和M,其中M的化学式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示的是物质A~G相互间的关系(“ →” 表示物质间存在的转化关系,“—”表示两端的物质能发生化学反应)A、F都是单质;F是使用最多的金属材料; B是导致温室效应的主要气体;在工业上,C广泛用于玻璃、造纸、纺织和洗涤剂的生产等;E是一种蓝色溶液。请回答:
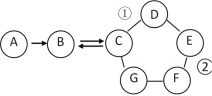
(1)C的化学式______________,G可能是______________。
(2)写出E的一种用途________________。
(3)写出标号①、②的化学反应方程式:
①__________。
②_________,反应的类型属于____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】KNO3与NH4Cl的溶解度曲线如图.下列说法错误的是
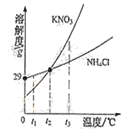
A. 常温下,NH4Cl易溶于水
B. t2°C时,两种溶液中溶质的质量分数一定相等
C. t3°C时,KNO3的溶解度大于NH4Cl的溶解度
D. 两种饱和溶液从t2°C降到t1°C时,均有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
【查阅资料】CaC12 滚液显中性
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12 猜想II:有__________
猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品 Na2CO3的俗名为_______ ,副产品氯化铵在农业上常可用作________ 。
(2)工业制法获得的 Na2CO3中常含有 NaCl 杂质,用下述方法可以测定固体样品中NaCl的质量分数。请分析实验操作流程,回答下列问题:

①“研磨”的目的是_________________________ 。
②“滤液”中溶质的成分是 ________________(填化学式)。
③“操作”主要有过滤、洗涤、低温烘干、冷却和称量,其中“检验沉淀是否洗涤干净”所用的试剂为 _______________溶液(填化学式)。
④计算 11 g 固体样品中 NaCl 的质量分数(计算结果精确到 0.1%)___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】合金是重要的金属材料.
(1)下列物品所使用的主要材料属于合金的是_____;
A青花瓷瓶 B橡胶充气艇 C不锈钢锅
(2)生铁是常见的合金,生铁属于_____(填“纯净物”或:混合物)
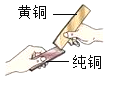
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片行留下明显的划痕,说明_____.
(4)黄铜渣中主要含Zn、ZnO、Cu、CuO,其余为杂质,处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参加反应);
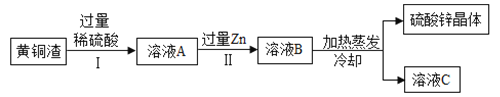
下列说法正确的是_____;
A Ⅰ、Ⅱ中的操作均包括过滤
B 溶液A一定为无色
C 溶液A的质量小于溶液B.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为甲、乙两种固体物质的溶解度曲线,下列有关说法中错误的是

A. 40℃时,两种物质的饱和溶液的溶质质量分数相等
B. 60℃时,将甲、乙的饱和溶液都蒸发掉10g水,析出甲的晶体质量比析出乙的晶体质量大
C. 20℃时,甲物质的溶解度比乙物质的溶解度大
D. 60℃时,将30g甲物质放入50g水中,所得溶液中溶质质量与溶剂质量之比是3:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com