
| A. | 水由氢分子和氧原子构成 | B. | 浑浊的水经过滤后就得到纯净的水 | ||
| C. | 有水生成的反应一定是中和反应 | D. | 用水可以鉴别碳酸钙和碳酸钠 |
分析 A、根据水的微观构成,进行分析判断.
B、根据过滤只能除去不溶性杂质,进行分析判断.
C、中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水,进行分析判断.
D、根据碳酸钠易溶于水,碳酸钙难溶于水,进行分析判断.
解答 解:A、水是由水分子构成的,故选项说法错误.
B、浑浊的水经过滤后,不能除去可溶性钙镁化合物,不能得到纯净的水,故选项说法错误.
C、有水生成的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项说法错误.
D、碳酸钠易溶于水,碳酸钙难溶于水,用水可以鉴别,故选项说法正确.
故选:D.
点评 本题难度不大,掌握中和反应的特征、水的微观构成、物质鉴别题的解题原理等是正确解答本题的关键.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:初中化学 来源: 题型:实验探究题
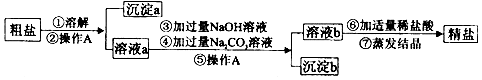
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用盐酸除去铁锈 | B. | 用氨水(NH3•H2O)处理工厂的硫酸 | ||
| C. | 用碳酸钙作补钙剂 | D. | 用含氧化镁的药物治疗胃酸过多 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
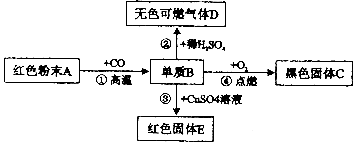
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
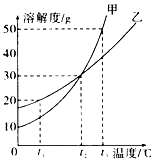
| A. | t3℃时,要使质量相同的甲、乙两种物质全部溶解,至少需要的水的质量乙大于甲 | |
| B. | t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 | |
| C. | t2℃时,甲、乙饱和溶液的溶质质量分数都为30% | |
| D. | t2℃时,甲、乙的饱和溶液分别降温至t1℃,降温后甲溶液饱和而乙溶液不饱和 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
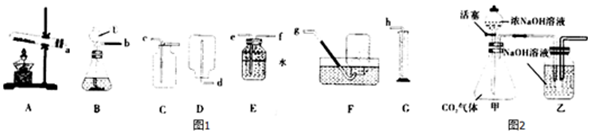
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
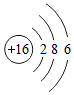 ;(4)4个氢原子4H;
;(4)4个氢原子4H;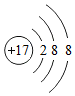 表示的是Cl-;(10)地壳中含量最多的金属元素Al.
表示的是Cl-;(10)地壳中含量最多的金属元素Al.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
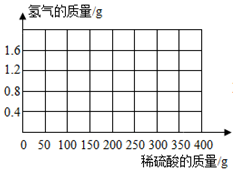 为了测定某种黄铜(铜和锌的合金)的组成,现取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:(Zn+H2SO4═H2↑+ZnSO4)
为了测定某种黄铜(铜和锌的合金)的组成,现取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:(Zn+H2SO4═H2↑+ZnSO4)| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加人稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com