
分析 (1)生成的二氧化碳的质量代入方程式即可解答;
(2)根据生成二氧化碳的质量求出参加反应的盐酸溶质的质量,再根据溶质质量分数公式计算即可;
(3)硫酸与碳酸钙反应生成微溶性的硫酸钙,覆盖在碳酸钙的表面,使碳酸钙与硫酸不再接触而反应停止.
解答 解:(1)设参加反应的碳酸钙质量是x,参加反应的盐酸溶液的溶质的质量是y
CaCO3+2HCl═CaCl2+CO2↑+H2O;
100 73 44
x y 11g
$\frac{100}{x}=\frac{73}{y}=\frac{44}{11g}$
x=25g y=18.25g
(2)参加反应的盐酸溶液的质量分数是$\frac{18.25g}{100g}$×100%=18.25%
(3)实验室制备二氧化碳气体应用大理石和盐酸反应,不宜用硫酸,因为硫酸与碳酸钙反应生成的硫酸钙是微溶于水的物质,当反应进行到一定程度时,硫酸钙会包住碳酸钙表面,使碳酸钙与硫酸不再接触而反应停止,所以实验室一般用盐酸而不用硫酸与大理石反应制取二氧化碳.
答:
(1)参加反应的碳酸钙质量是25g;
(2)参加反应的盐酸溶液的质量分数是18.25%;
(3)不能;硫酸与碳酸钙反应生成的硫酸钙是微溶于水的物质,当反应进行到一定程度时,硫酸钙会包住碳酸钙表面,使碳酸钙与硫酸不再接触而反应停止,所以实验室一般用盐酸而不用硫酸与大理石反应制取二氧化碳.
点评 本题主要考查学生运用化学方程式和质量分数公式进行计算的能力,并明确实验室制取二氧化碳不用稀硫酸的原因.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 组别 药品质量 | 甲 | 乙 | 丙 | 丁 |
| 取用石灰石的质量(g) | 10 | 10 | 20 | 20 |
| 取用稀盐酸的质量(g) | 50 | 100 | 50 | 100 |
| 反应后过滤得到干燥固体的质量(g) | 2 | 2 | 12 | 4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
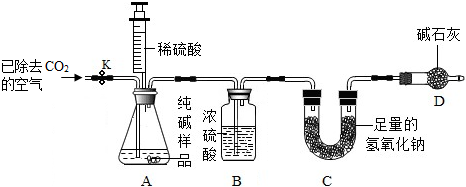
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com