
【题目】益生菌能够维持皮肤上菌群平衡,它在酸性较弱的环境中利于生长。因此皮肤的酸碱度宜保持在
A.pH<0 B.4.5<pH<6.5 C.8<pH<10 D.pH>10
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:初中化学 来源: 题型:
【题目】在一密闭容器中加入甲、乙、丙、丁四种物质,在运动条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中不正确的是

A. 该反应为化合反应
B. 丙可能为该反应的催化剂
C. 该反应中,乙、丁的质量变化之比为7:5
D. 该反应中,甲、乙的质量变化之比为1:4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、 乙、丙
三种物质的饱和溶液(无固体存在)。 下列说法正确的是
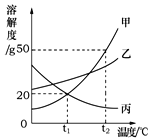
A.三种物质溶解度大小依次为:甲>乙>丙
B.将温度由t2℃降到t1℃时,析出甲的质量比乙多
C.若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯
D.将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙=甲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和
水。某化学课外兴趣小组对生成物中碳的氧化物种类进行了如下实验探究:
【提出问题】生成物中有哪几种碳的氧化物?
【猜测】
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有 | 含有CO和CO2 |
【设计实验】基于猜想3,依据CO和CO2的性质,兴趣小组同学设计了如下实验:

【实验探究】
(1)观察到 装置(填序号)中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成。
(2)有两种实验现象都能分别证明草酸分解的气体中含有CO,分别是:
①E装置中出现 的现象;
② 。
【实验结论】通过实验探究证明:猜测3成立。
草酸分解的化学方程式是 。
【问题讨论】
(1)B装置的作用是 ,装置末端酒精灯的作用是 。
(2)如E装置中硬质玻璃管(含内容物)实验前质量为112.5 g,实验后质量为109.3 g,则参与反应的氧化铜质量为 g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回收利用废金属可减少资源浪费和环境污染。某工厂利用含铜废料(含Cu、Zn,其他杂质不溶于水、不参加反应)制取铜并得到硫酸锌溶液,主要流程如下。

已知:2Cu + 2H2SO4 + O2 ![]() 2CuSO4 + 2H2O
2CuSO4 + 2H2O
(1)操作②和③的名称是 。
(2)溶液A中一定含有 。
(3)固体C中含有 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
“疯狂”的星球

金星是太阳系中八大行星之一,中国古代称之为长庚、启明、太白金星。金星地表大气压约是地球的90倍,大气成分主要由二氧化碳组成,约占96%,因此它的地表具有强烈的温室效应,在近赤道的低地,温度可高达500°C。
在高度50至70公里的金星上空,悬浮着浓密的厚云,把大气分割为上下两层。你知道吗?地球云层的主要成分是水(水的液滴),而金星云层的主要成分是硫酸(硫酸的液滴),其中还掺杂着硫的粒子,所以呈现黄色。H2SO4的生成主要源于太阳光中波长短于160nm的紫外光对CO2的光解,使其变为CO和原子氧,原子氧非常活泼,能与SO2反应变为SO3,SO3与水反应变为H2SO4,在金星,下的雨真是名副其实的酸雨。金星里,H2SO4的形成过程是不断循环的,H2SO4从大气较高较冷的区域降至较低较热的区域,当温度达到300℃时,H2SO4开始分解为SO3和水,SO3再分解为SO2和原子氧,原子氧接着与CO反应变为CO2。SO2与水会上升到上层,重新反应又释放出H2SO4。
依据文章内容,回答下列问题。
(1)金星地表具有强烈的温室效应是因为____________。
(2)原子氧的符号为____________。
(3)硫酸分解反应的化学方程式为____________。
(4)在硫酸循环的过程中,下列说法正确的是____________(填字母序号)。
A. CO2光解变为CO和原子氧的变化为化学变化
B. SO3与水反应变为H2SO4为化合反应
C. CO变为CO2的过程中原子氧是催化剂
(5)金星被称为“疯狂”星球的原因是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】侯德榜是我国化学工业的奠基人,纯碱工业的创始人。他发明的“侯氏制碱法”,缩短了生产流程,减少了对环境的污染,在人类化学工业史上写下了光辉的一页。侯氏制碱法的主要反应为:
NH3 + CO2 + H2O + NaCl = NaHCO3 + NH4Cl ,

他利用生成物中的NaHCO3溶解度较小,一经生成便会大量析出,能够很容易的分离出NaHCO3。
化学小组同学模拟“侯氏制碱法”完成以下实验:10℃时,向92.6g饱和NaCl溶液中先通入足量NH3共3.4g,再通入一定量CO2至恰好完全反应。请计算:(不考虑溶解在溶液中的NH3和CO2的质量)。
(1) NH4Cl可作为氮肥使用,其中氮元素的质量分数(只写出计算过程)___________。
(2) 以上反应中消耗CO2的质量是多少?
(3) 反应后称量溶液中析出NaHCO3晶体的质量为14.4g,则剩余溶液的质量是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com