
| A. | 加速溶解 | B. | 引流 | C. | 加快蒸发 | D. | 防止液体溅出 |
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:初中化学 来源: 题型:解答题
 近年来,我国的高铁建设得到了飞速发展,从整车进口到技术引进,再到自主生产,动车组列车已经完全国产化,并且引领国际潮流,“高铁外交”作为国家新名片,开启中国外交的3.0时代.高铁铁轨采用长距离无缝钢轨,用得较多的是高碳微锰钢.请回答:
近年来,我国的高铁建设得到了飞速发展,从整车进口到技术引进,再到自主生产,动车组列车已经完全国产化,并且引领国际潮流,“高铁外交”作为国家新名片,开启中国外交的3.0时代.高铁铁轨采用长距离无缝钢轨,用得较多的是高碳微锰钢.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向醋酸中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
| B | 向溶质质量分数为5%的过氧化氢溶液中加少量氧化铜 | 有大量气泡产生 | 氧化铜起催化作用 |
| C | 将两根铁丝分别伸入硫酸铜溶液和硝酸银溶液中 | 两根铁丝上均有固体附着 | 金属的活动性顺序为Fe>Cu>Ag |
| D | 用导管分别对准浸没在热水和冷水中的白磷通气 | 热水中的白磷燃烧,冷水中的白磷不燃烧 | 燃烧的条件之一是温度达到着火点 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
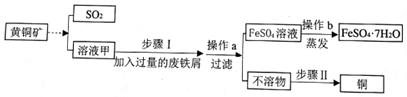
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
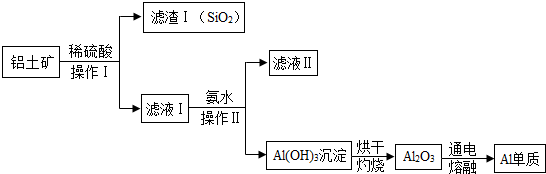
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KMnO4、CuCl2、Fe2(SO4)3、NaNO3 | B. | H2SO4、HCl、AgNO3、Na2SO4 | ||
| C. | NaNO3、NaCl、KNO3、(NH4)2SO4 | D. | K2SO4、NaCl、K2CO3、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
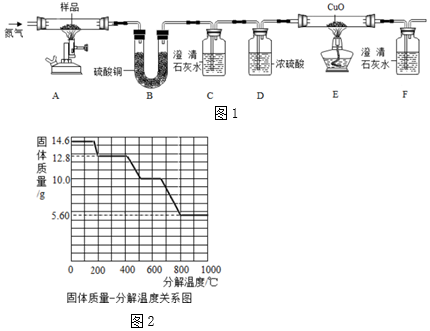
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com