解答:解:(1)实验室制取二氧化碳用大理石或石灰石和稀盐酸反应,同时生成氯化钙、水和二氧化碳,方程式是:CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;
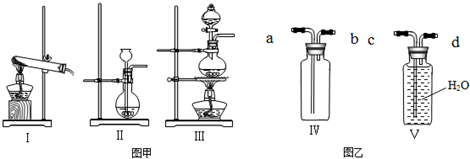
(2)①实验室制取二氧化碳用大理石或石灰石和稀盐酸反应,属于固液常温型,故制取CO
2应选取Ⅱ;Ⅲ装置适用于固体和液体加热制取气体,根据三种气体的反应原理可知,实验室用二氧化锰和浓盐酸加热制取氯气可用此装置;
②排水法收集不溶于水或不易溶于水的气体,氯气和二氧化碳能溶于水,故不能用排水法收集,利用排水法收集时,要从短管进气,长管便于排水;
(3)氯化钾易溶于水,二氧化锰不溶于水,所以从剩余固体中分离出MnO
2可用过滤的方法,先溶解再过滤;过滤时所用的玻璃仪器有烧杯、玻璃棒、漏斗;
(4)用100g 36.5%的浓盐酸与足量MnO
2混合加热,二氧化锰足量,说明盐酸完全反应,参加反应的盐酸溶质的质量是:100g×36.5%=36.5g;
设理论上能制得Cl
2的质量为x
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
146 71
36.5g x
=
x=17.75g
实际收集到的Cl
2质量远远小于这个数值,若操作正确,装置的气密性没有问题,可能是容器内残留一部分氯气或收集时部分氯气逸出导致;浓盐酸与足量MnO
2反应制取Cl
2,反应需要加热,氯化氢易挥发,加热时部分HCl挥发,同时反应消耗氯化氢,并生成水,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不与MnO
2反应,所以氯气的质量偏小,还可能是此原因;
(5)①方法1:生成氧气的质量为:8g+1g-4.2g=4.8g;
设生成氯化钾的质量为x,
2KClO
3 2KCl+3O
2↑
149 96
x 4.8g
∴
=
解得:x=7.45g;
方法2:
据题意:氯酸钾和二氧化锰混合充分反应完全,则氯酸钾完全分解,设生成氯化钾的质量为y
2KClO
3 2KCl+3O
2↑
245 149
8g y
=
解得y≈4.9g
②所剩固体的质量=4.2g<7.45g,也小于4.9g,所以题目有错误;
如果完全反应后剩余固体质量为4.2g,则生成的氯化钾的质量是 4.2g-1g=3.2g
设氯酸钾质量为b,
2KClO
3 2KCl+3O
2↑
245 149
b 3.2g
=
解得:y≈5.3g;
假设氯酸钾没有反应,则其质量为:4.2g-1g=3.2g.
由于氯酸钾一定会分解,只是分解完全与否的问题,所以氯酸钾质量一定大于3.2g.故a的取值范围是:3.2g<a≤5.3g;
故答案为:
(1)CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;
(2)①Ⅱ;Cl
2;②a;O
2;d;
(3)溶解、过滤;烧杯、玻璃棒、漏斗;
(4)17.75;容器内有残留的部分氯气没有排出来;随着反应进行,盐酸浓度变小,MnO
2与稀盐酸不反应,该反应停止(合理均可);
(5)①方法1:生成氯化钾的质量是7.45g,方法2:生成氯化钾的质量是4.9g;
②3.2g<a≤5.3g.