【答案】
分析:探究性题目的做法是大胆推测,但要有合理的依据,不能凭空猜想;根据质量守恒定律可知,碱式碳酸铜[Cu
2(OH)
2CO
3]的产物是有Cu、O、H、C中的一种或多种元素组合而成;根据题目信息(黑色粉末)可知,黑色物质可以是题目所说的三种情况.
实验方案(1)根据氧化铜和硫酸的性质及其产物的颜色解决即可.
(2)根据氧化铜和硫酸的性质及其产物的颜色,结合碳不与硫酸反应的事实解决.
思考:(1)利用质量守恒定律元素的质量守恒解决即可.
(2)碳和氧化铜在高温情况下会发生反应可知;利用实验的事实结合质量守恒定律以及产物与硫酸的反应书写有关的方程式即可.
解答:解:(1)氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜的水溶液的颜色是蓝色的;
故答案为:试管中溶液变成蓝色,黑色固体消失(或没有黑色固体剩余).
(2)氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜的水溶液的颜色是蓝色的;但是碳不会和硫酸反应;
故答案为:试管中溶液变成蓝色,仍有黑色固体剩余.
思考:(1)根据质量守恒定律可知,反应前后元素的种类、质量均不发生改变;反应前的碳的质量是:
11.1×(

×100%)═0.6g,但是黑色粉末的质量是8g,因此排除②;
故答案为:11.1g碱式碳酸铜中含有C:
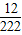
×11.1g=0.6g<8.0g.
(2)假如是氧化铜和碳的混合物,它们在高温条件下反应生成铜和二氧化碳;也就是两者不能共存.
实验证明该黑色固体是氧化铜,依据质量受很定律元素的种类不变可知另外的产物是二氧化碳和水,同时可结合产物与硫酸的反应书写碱式碳酸铜与硫酸的反应.
故答案为:在高温下碳可以和氧化铜反应,也就是不能共存.
结论:Cu
2(OH)
2CO
3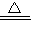
2CuO+H
2O+CO
2↑;
反思:Cu
2(OH)
2CO
3+2H
2SO
4═2CuSO
4+3H
2O+CO
2↑.
点评:本题主要考查了利用所学过的知识,通过实验探究碱式碳酸铜的受热分解产物,其中涉及到依据碳和氧化铜的化学性质不同,选择合适的试剂并根据实验现象对二者进行鉴别的问题.

 ×100%)═0.6g,但是黑色粉末的质量是8g,因此排除②;
×100%)═0.6g,但是黑色粉末的质量是8g,因此排除②;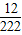 ×11.1g=0.6g<8.0g.
×11.1g=0.6g<8.0g.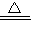 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑;

 小学教材完全解读系列答案
小学教材完全解读系列答案