
| A. | NO | B. | N2 | C. | NO2 | D. | N2O |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
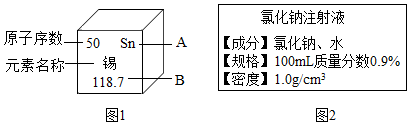
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+ | |
| B. | 滤纸上有Ag,滤液中有Cu2+、Fe2+ | |
| C. | 滤纸上有Ag、Cu、Fe,滤液中有Fe2+ | |
| D. | 滤纸上有Ag、Cu、Fe,滤液中有Ag+、Cu2+ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 硒属于金属元素 | B. | 硒的原子结构示意图中x=4 | ||
| C. | 硒的原子序数是34 | D. | 硒 相对原子质量是78.96g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加入二氧化锰可使氯酸钾产生更多的氧气 | |
| B. | 液态空气可以发生分解反应生成氮气和氧气 | |
| C. | 二氧化锰可使过氧化氢溶液在常温下迅速产生氧气 | |
| D. | 为了便于运输,把氧气溶于水制成液氧并贮存于蓝色钢瓶中 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
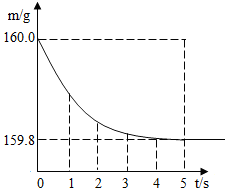 小李要测定某Cu-Zn合金中铜的质量分数,做了如下实验.
小李要测定某Cu-Zn合金中铜的质量分数,做了如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com