
| A. | K2Cr2O7中Cr元素的化合价为+6价 | |
| B. | NH4NO3中氮、氢、氧原子个数比为2:4:3 | |
| C. | C2H4与C4H8中碳元素和氢元素的质量比相同 | |
| D. | 已知20℃时,NaCl的溶解度为36g,则该温度下氯化钠饱和溶液的质量分数为36% |
分析 A、根据在化合物中正负化合价代数和为零,结合重铬酸钾(K2Cr2O7)的化学式进行解答;
B、根据NH4NO3的含义进行分析解答;
C、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析;
D、根据20℃时,氯化钠饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%进行解答.
解答 解:A、钾元素显+1价,氧元素显-2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x+(-2)×7=0,则x=+6,故计算正确;
B、由硝酸铵的化学式可知,硝酸铵中N、H、O三种元素的原子个数比为2:4:3,故计算正确.
C、C2H4与C4H8分子中碳原子个数与氢原子个数比均为1:2,因此C2H4与C4H8中碳元素和氢元素的质量比相同,故计算正确;
D、20℃时,氯化钠饱和溶液的溶质质量分数=$\frac{36g}{100g+36g}$×100%=26.5%,故计算错误.
故选D.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
| 白色粉末的成分 | 形成的原因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应; 化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O |
| 可能是Ca(OH)2 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取上述试管中的上层清液,滴加1~2无色酚酞试液 | 酚酞试液变红色 | 白色粉末中有Ca(OH)2 |
| 往上述试管中的残留的固体中加入稀盐酸 | 有气泡产生 | 白色粉末中有(选填“有”或“无”)CaCO3 |
| 由上述实验可知白色粉末的成分是:Ca(OH)2和CaCO3的混合物. | ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
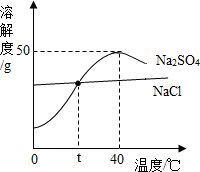 已知某地盐湖含丰富的氯化钠和硫酸钠.图为硫酸钠和氯化钠的溶解度曲线,下列说法正确的是( )
已知某地盐湖含丰富的氯化钠和硫酸钠.图为硫酸钠和氯化钠的溶解度曲线,下列说法正确的是( )| A. | 硫酸钠与氯化钠的溶解度均随温度升高而增大 | |
| B. | 无法比较t℃时饱和氯化钠溶液与饱和硫酸钠溶液的溶质质量分数大小关系 | |
| C. | 40℃时,100g饱和硫酸钠溶液的含溶质50g | |
| D. | 从当地盐湖水中获取氯化钠,应采用蒸发结晶方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com