
【题目】过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O===2Ca(OH)2+O2↑。某同学把20g不纯的过氧化钙样品(杂质不与水反应)加入到盛有50g水(足量)的烧杯中,完全反应后,称量烧杯内物质的总质量为66.8g。请计算:
(1)生成氧气_____g;
(2)该样品中过氧化钙的质量分数_____。(根据化学方程式计算)
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】今有下列实验室制取气体的装置,请回答问题:
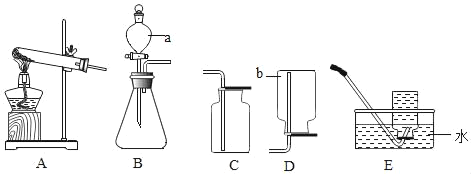
(1)实验室若用过氧化氢溶液在二氧化锰催化作用下制取并收集一瓶氧气,选用的气体制取装置是_____(填序号),若选用C装置来收集,验满的方法是_____;可选用E装置来收集氧气的依据是_____,开始收集的最佳时机是_____.
(2)用大理石和稀盐酸制取一瓶二氧化碳.需要用到的装置为_____;实验室常用氯化铵固体与碱石灰共热制取氨气,应选择的发生装置是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以CO2为碳源,与电解水产生的H2经催化可转化为高附加值的有机物,此方法具有重要的战略意义。中国化学家使用特殊的催化剂实现了CO2和H2转化为A或B等有机物,反应原理如下图所示:
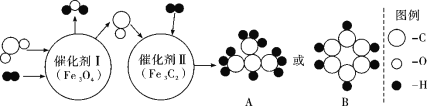
请回答下列问题:
(1)B的化学式是_________。
(2)根据催化剂的特性可知,催化剂在该反应前后,其质量和_________不变。
(3)在催化剂Ⅰ中发生反应的化学方程式是_________。
(4)由CO2 和H2反应生成A的总反应化学方程式是_________。
(5)如果该反应工业化生产后的重要意义是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学对一包久置的生石灰(化学式为CaO)干燥剂产生了好奇,于是他们对这包干燥剂的成分展开了探究。
【资 料】生石灰与水发生的反应属于放热反应
【提出问题】这包干燥剂是否变质,成分是什么?
【猜想假设】
猜想一:全部是CaO;猜想二:是CaO和Ca(OH)2的混合物;猜想三:全部是Ca(OH)2;猜想四:是Ca(OH)2和CaCO3的混合物。
【实验探究】
(1)取部分该干燥剂于试管中,加水后无放热现象,说明这包干燥剂中不含________。
(2)继续向试管中滴加足量稀盐酸,有气泡出现,说明这包干燥剂中含有__________。
(3)为了进一步确定这包干燥剂中有无其他成分,小组同学设计了以下两种方案。
另取部分干燥剂于烧杯中,加水并搅拌,静置后取上层清液于2支试管中,请你参与实验并完成表中空白。
实验方案 | 方案一 | 方案二 |
实验操作 |
|
|
实验现象 | 溶液由无色变为红色,则溶液的PH______7 (填“﹤”“﹥” 或“﹦”) | 澄清溶液变浑浊 |
写出方案二发生的化学反应方程式_______________________________。
【实验结论】通过以上实验探究,得出猜想___________成立。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关量的变化图像与其对应叙述不相符的是
A.  红磷燃烧装置内压强变化
红磷燃烧装置内压强变化
B.  往 盐 酸 与 氯 化 铁混合溶液中加入氢 氧化钠溶液
往 盐 酸 与 氯 化 铁混合溶液中加入氢 氧化钠溶液
C.  浓盐酸、浓硫酸敞口放置于空气中
浓盐酸、浓硫酸敞口放置于空气中
D. 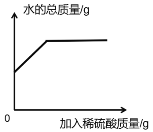 往氢氧化钡溶液中 加入稀硫酸溶液
往氢氧化钡溶液中 加入稀硫酸溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请你参与下列实验活动:
(1)做甲、丙实验时,事先都需在集气瓶底部装有少量水,其作用分别是:甲_____, 丙______。甲中铁丝绕成螺旋状的目的是 。
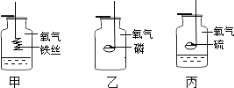
(2)做实验甲时,铁丝在氧气中剧烈燃烧,而在空气中只是发红并未燃烧;做实验丙 时,硫在氧气中燃烧比在空气中燃烧剧烈。据此,说明可燃物能否燃烧或燃烧的剧烈程度与 有关。
(3)将装置乙改装为下图所示装置还可用于测定空气中氧气的体积分数:经测定,集气瓶的容积为250mL,在此实验中,观察到量筒中减少的水的体积为50mL,则空气中氧气的体积分数为______。在保证整个装置不漏气的前提下,所用红磷的量必须_____,如果未冷却到室温便打开弹簧夹观察量筒内减少的水的体积,则实验结果将(填“偏大”、“偏小”或“不变”)______。
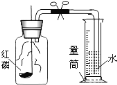
(4)小晴同学找来废弃的医疗用品——微型Y 形管,对课本探究分子运动的实验进行了改进(如图所示),与课本上的实验装置相比较,
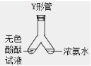
该装置的优点是① ,② 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下图所示实验,回答下列问题:
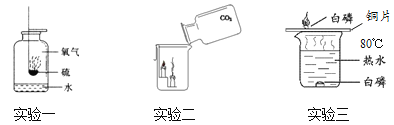
(1)在实验一中,水的作用是_____;
(2)由实验二可知,CO2具有的物理性质是____;
(3)在实验三中,铜片上的白磷燃烧,红磷不燃烧,由此能够得出燃烧的条件之一是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如图操作流程:请回答:
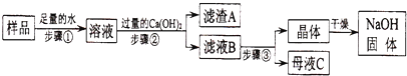
(1)步骤②反应的化学方程式为________;加入过量Ca(OH)2的目的是________
(2)滤液B中的溶质是________、________(写化学式);步骤③所包含的具体操作是加热浓缩、________、过滤.
(3)探究变质NaOH固体中碳酸钠的质量分数.
(设计实验)甲组同学:称取20.0g样品,放入足量的溶质质量分数为14.6%的稀盐酸直到反应停止,共收集到4.40g二氧化碳.
乙组同学:称取20.0g样品,加水配成溶液,向溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.0g.
(解决问题)
根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:________.(请写出计算过程 Ca:40 C:12O:16H:1Na:23)
(4)(交流与反思)
在交流时,老师问同学们“能否用上述实验所得的数据计算出样品中氢氧化钠的质量分数”,甲乙两组的同学都一致认为可以.但小明思考后,觉得甲、乙两种方案都不妥,理由是:________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有氧元素。申、乙是组成元素完全相同的化合物,丙是单质;乙通常为液体,在一定条件下可分解成丙;它们之间有如右图所示的转化关系。则:甲的化学式为_______ ;乙分解生成丙的化学方程式为______________________________。
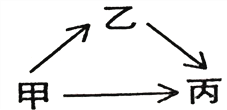
从微观的角度解释甲、乙性质有差异的原因是_________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com