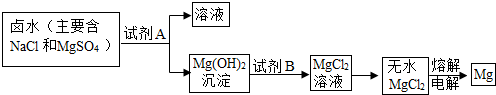
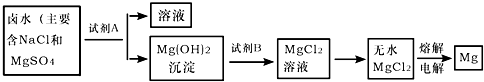
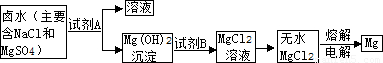
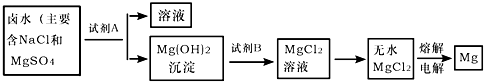
解:(1)海水中含量最多的盐是氯化钠;从海水中提取盐最常用的方法是蒸发;
(2)该市含有较丰富的石灰石资源,而锻烧石灰石可以得到氧化钙,而氧化钙溶于水可制得氢氧化钙溶液,所以A试剂应是氢氧化钙溶液,该实验流程如下:向NaCl、MgSO
4的混合溶液中加入试剂A即Ca(OH)
2后可得到Mg(OH)
2沉淀,向Mg(OH)
2沉淀中加入B,即稀盐酸可得到MgCl
2溶液,所以试剂B为稀盐酸;
(3)①由“侯氏制碱法”的基本原理可知:首先是浓氨水和二氧化碳反应生成一种盐(NH
4HCO
3),在盐溶液中加入细小的食盐粉末,析出碳酸氢钠,碳酸氢钠不稳定,加热后生成纯碱(Na
2CO
3)、水和二氧化碳,部分原料可以循环使用.通过分析可知进行实验时,所用的起始原料为:NH
3、CO
2、NaCl.
②由实验原理可知:发生的反应有 NH
3+H
2O+CO
2═NH
4HCO
3,NH
4HCO
3+NaCl═NH
4Cl+NaHCO
3;2NaHCO
3
Na
2CO
3+CO
2↑+H
2O 所以最终产品是Na
2CO
3、NH
4Cl;
③由②的分析可知实验过程中发生的反应有:NH
3+H
2O+CO
2═NH
4HCO
3,NH
4HCO
3+NaCl═NH
4Cl+NaHCO
3;2NaHCO
3
Na
2CO
3+CO
2↑+H
2O;
④分析③中所写的化学方程式可以知道为化合反应,为复分解反应,为分解反应,所以没出现的反应为置换反应;
⑤A、由(2)的分析可知反应生成的CO
2可以循环作为起始原料使用,故A正确;
B、因为副产品(NH
4Cl)含有氮元素(N)属于氮肥,故B正确;
C、因为副产品是NH
4Cl、CO
2、H
2O 都不污染环境,,故C正确;
D、因为2NaHCO
3
Na
2CO
3+CO
2↑+H
2O 这个反应需要加热故D错;所以应选ABC.
故答案为:(1)氯化钠;蒸发;
(2)Ca(OH)
2;稀盐酸;
(3)①NH
3、CO
2、NaCl;
②Na
2CO
3、NH
4Cl;
③NH
3+H
2O+CO
2═NH
4HCO
3,NH
4HCO
3+NaCl═NH
4Cl+NaHCO
3;2NaHCO
3
Na
2CO
3+CO
2↑+H
2O;
④置换反应;
⑤ABC.
分析:(1)根据海水中含量最高的盐为氯化钠及海水晒盐的原理来解答;
(2)根据题中信息该市含有较丰富的石灰石资源结合加入试剂A后得到产物可以完成解答;
(3)由题给的信息可以判断,原料就是浓氨水、二氧化碳和NaCl;最终产物就是NH
4Cl和Na
2CO
3;三个化学方程式也可很容易的写出来.可以据此完成该题的解答.
点评:要想解答好这类题目,首先,要理解和熟记对海洋资源的合理开发与利用,以及与之相关的知识.然后,根据所给的问题情景结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

 Na2CO3+CO2↑+H2O 所以最终产品是Na2CO3、NH4Cl;
Na2CO3+CO2↑+H2O 所以最终产品是Na2CO3、NH4Cl; Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;  Na2CO3+CO2↑+H2O 这个反应需要加热故D错;所以应选ABC.
Na2CO3+CO2↑+H2O 这个反应需要加热故D错;所以应选ABC. Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;