
(8分)同学们对实验“煅烧石灰石”展开深入探究。
资料:石灰石中的杂质高温不分解且不与稀盐酸反应
(1)为证明石灰石已分解,三位同学设计方案如下:
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式 。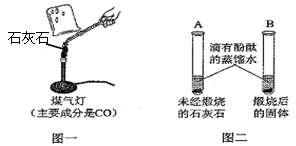
II.乙同学按图二所示进行试验,观察到B中液体变 色,A实验的作用 。
III.丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,证明石灰石已分解。
IV.大家认为甲同学的方案不合理,请分析原因 。
(2)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,结合上述数据计算:丙所取的这块石灰石中碳酸钙的质量分数是多少?
计算过程写在答卷上
(1)ⅠCO2+Ca(OH)2=CaCO3↓+H2O Ⅱ 红 对比 Ⅳ CO燃烧会产生CO2
(2)83.3%
解析试题分析:(1)Ⅰ、烧杯内壁石灰水变浑浊,发生的化学反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,
Ⅱ、乙同学按图二所示进行试验,未煅烧的石灰石不溶于水,煅烧后生成了氧化钙,氧化钙和水发生反应,生成了氢氧化钙,水溶液呈碱性,所以滴入酚酞的蒸馏水后,液体变为红色,A实验的作用对比
IV、甲同学的方案不合理的原因是:煤气灯的燃料是一氧化碳,而CO燃烧会产生CO2
(2)根据反应:CaCO3 CaO+CO2↑,丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,说明该反应生成了2.2g二氧化碳,这样便可计算出发生分解的碳酸钙质量,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,说明发生了反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,这样同样可以计算出剩余碳酸钙的质量
CaO+CO2↑,丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,说明该反应生成了2.2g二氧化碳,这样便可计算出发生分解的碳酸钙质量,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,说明发生了反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,这样同样可以计算出剩余碳酸钙的质量
解:设加热分解的碳酸钙的质量为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
x 2.2g
100:44=x:2.2g x=5g
设剩余碳酸钙的质量为y
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
y 2.2g
100:44=y:2.2g y=5g
考点:碳酸钙、氧化钙、氢氧化钙的化学性质,根据化学方程式计算


科目:初中化学 来源: 题型:单选题
实验室有一瓶久置的氧化钙,因吸收空气中的水蒸气和二氧化碳而变质,经测定该固体中 氢元素的质量分数为0.8%,碳元素的质量分数为2.4%。则已变质的氧化钙占变质前纯氧化钙的质量分数为( )
| A.80% | B.66.7% | C.40% | D.18.8% |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4+ 4HCl → 4NaCl + 2CO2↑+ O2↑+ 2H2O
【实验装置】
【交流与讨论】
①甲同学认为测定产物中O2的体积即可测定样品的纯度。装置②的作用是:(15);装置③的作用是:(16);
②乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是;(17)(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
③丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,得到0.2mol氯化钠。则该样品的中过碳酸钠的质量分数为多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
晓东在实验室发现了一瓶敞口放置的过氧化氢溶液,他认为该溶液中溶质的质量分数减小了需要重新测定并更换试剂瓶的标签.他做了如下实验:称量该溶液34.0g倒入烧杯中,然后向其中加入0.4g二氧化锰,直到不再放出气体后,再称量烧杯中混合物的质量,称量结果为33.6g.
(1)生成的气体的质量为 ;
(2)计算该瓶过氧化氢溶液中溶质的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液.为了测定该混合溶液中碳酸钠的质量分数,该同学设计了如下实验:取该混合溶液50g,向其中逐滴加入稀盐酸,当加入盐酸的质量为15g、30g、45g、60g时,生成气体的质量见下表(气体的溶解度忽略不计).
| | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 |
| 稀盐酸的质量/g | 15 | 30 | 45 | 60 |
| 生成气体的质量/g | 1.8 | n | 4.4 | 4.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将一定质量的甲烷和一氧化碳的混合气体在足量的氧气中充分燃烧,将生成物依次通入盛有足量浓硫酸和氢氧化钠溶液的洗气瓶,实验测得装有浓硫酸的洗气瓶增重5.4克,装有氢氧化钠溶液的洗气瓶增重8.8克。试计算:
(1)混合气体中甲烷的质量(写出完整的计算过程)
(2)混合气体中甲烷和一氧化碳的质量之比为______,混合气体中碳、氢、氧三种元素的质量之比为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸用量 | 剩余固体质量 | 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg | 第四次加入10g | 1.0g |
| 第二次加入10g | 2.0g | 第五次加入10g | 0.6g |
| 第三次加入10g | 1.5g | 第六次加入10g | 0.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)请根据下图所示的实验过程和提供的数据,回答以下问题。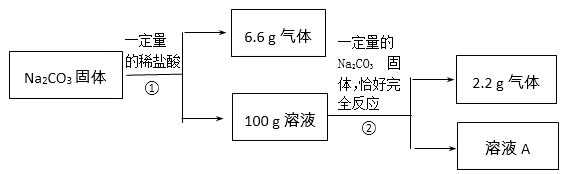
(1)过程②中产生气体的原因是______。
(2)计算溶液A的质量(写出计算过程,结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分)在电缆生产过程中会产生一定量的含铜废料。据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜。反应的化学方程式:2Cu + 2H2SO4 + O2△ 2CuSO4 + 2H2O,取490g溶质的质量分数为10%的稀硫酸,通入足量的空气,加入一定量的铜恰好完全反应,假设其他杂质不反应也不溶解,则反应后硫酸铜溶液中溶质的质量分数是多少?(计算结果保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com