(2012?湘潭)在研究酸和碱的化学性质时,某小组同学想证明:稀H
2SO
4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案设计、实施和评价.
(1)方案一:测定稀H
2SO
4与NaOH溶液混合前后的pH(常温下)他们先测定出某NaOH溶液的pH
大于
大于
7(填“大于”、“等于”或“小于”),然后将一定量的稀H
2SO
4加入该NaOH溶液中,混合均匀后再测定其pH,发现其pH小于7.
结论:稀H
2SO
4与NaOH溶液发生了化学反应,并且
稀硫酸
稀硫酸
过量.
(2)方案二:利用酸碱指示剂
①探究稀H
2SO
4与NaOH溶液的反应
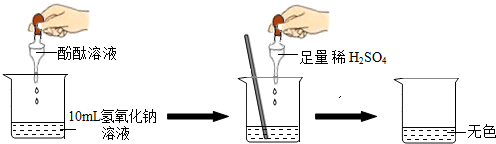
如图所示进行实验.当滴入几滴酚酞溶液后,溶液由无色变为
红
红
色.根据上述过程中的颜色变化,确定稀H
2SO
4与NaOH溶液发生了反应,该反应的化学方程式为
2NaOH+H2SO4═Na2SO4+2H2O
2NaOH+H2SO4═Na2SO4+2H2O
.
②探究上述稀H
2SO
4与NaOH溶液反应后烧杯中的硫酸是否过量
根据上述反应过程中溶液变成无色,不能确定稀H
2SO
4是否过量,同学们又分别选取BaCl
2溶液与、紫色石蕊溶液、Na
2CO
3粉末设计实验方案,请你判断并分析:
| 实验方案 |
实验步骤 |
实验现象 |
实验结论 |
| 方案一 |
取样,滴入适量的BaCl2溶液 |
出现白色沉淀 |
稀H2SO4过量 |
| 方案二 |
取样,滴入几滴紫色石蕊溶液 |
溶液变红 |
稀H2SO4过量 |
| 方案三 |
取样,加入Na2CO3粉末 |
有气体产生 |
稀H2SO4过量 |
方案三中反应的化学方程式为
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
.上述设计的实验方案中,不正确的是
方案一
方案一
(填“方案一”、“方案二”或“方案三”).错误的原因是
即使硫酸不过量,先前生成的硫酸钠也能和氯化钡反应生成白色沉淀
即使硫酸不过量,先前生成的硫酸钠也能和氯化钡反应生成白色沉淀
.请你再设计一个实验方案确定稀H
2SO
4是否过量,你选用
加入氧化铜,观察溶液的颜色变化,若显示为蓝色,则硫酸过量
加入氧化铜,观察溶液的颜色变化,若显示为蓝色,则硫酸过量
(填药品或者方法).

 通城学典默写能手系列答案
通城学典默写能手系列答案