

分析 利用质量守恒定律,由反应前后各物质质量总和的差值,计算出反应放出二氧化碳的质量;由二氧化碳的质量,根据反应的化学方程式,计算出鸡蛋壳中所含量碳酸钙的质量,即可求得该鸡蛋壳中碳酸钙的质量分数.
解答 解:
(1)蛋壳中碳酸钙的质量为 10g-4.3g=5.7g
鸡蛋壳中碳酸钙的质量分数为:$\frac{5.7g}{10g}$×100%=57%
根据质量守恒定律,产生二氧化碳的质量=10g+100g-106.7g=3.3g,所以丁同学的计算过程为:
设鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{x}$=$\frac{44}{3.3g}$
x=7.5g
该鸡蛋壳中碳酸钙的质量分数=$\frac{7.5g}{10g}$×100%=75%
(2)丙同学计算所用的蛋壳残渣可能未干燥,实际蛋壳残渣质量小于4.3克或丁同学计算所用的数据“3.3g”中包含了反应过程中盐酸挥发了的氯化氢气体的质量,即实际生成的二氧化碳气体质量小于3.3g
故答案为:
(1)57%;
设鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{x}$=$\frac{44}{3.3g}$
x=7.5g
该鸡蛋壳中碳酸钙的质量分数=$\frac{7.5g}{10g}$×100%=75%
(2)丙同学计算所用的蛋壳残渣可能未干燥,实际蛋壳残渣质量小于4.3g
点评 在进行表格计算时,首先学会分析表格的数据,通常要用到质量守恒定律,然后由数据得到化学方程式中的一部分数据,然后利用化学方程式进行计算,考查学生分析、解决问题的能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | H+、Na+、OH${\;}^{_}$、SO${\;}_{4}^{2-}$ | B. | K+、Na+、Cl-、CO${\;}_{3}^{2-}$ | ||
| C. | Cl-、CO${\;}_{3}^{2-}$、Ca2+、Na+ | D. | NH${\;}_{4}^{+}$、Na、OH-、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
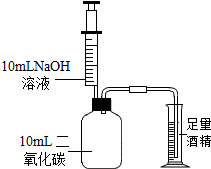 化学兴趣小组利用实验,探究二氧化碳、氢氧化钠的性质.
化学兴趣小组利用实验,探究二氧化碳、氢氧化钠的性质.| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量溶液,滴入 过量(填少量或过量)的CaCl2 | 产生白色沉淀 | 猜想① 错误 |
| b.向步骤a中的上层清液里,滴入酚酞试液 | 若溶液变红 | 则猜想③ 成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某校化学兴趣小组在实验室发现了一瓶标签受到腐蚀的溶液(如图),他们对该溶液是什么产生了兴趣.
某校化学兴趣小组在实验室发现了一瓶标签受到腐蚀的溶液(如图),他们对该溶液是什么产生了兴趣.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
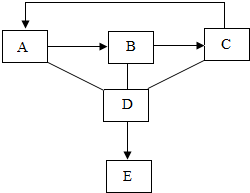 A、B、C、D、E为初中化学常见五种(酸、碱、盐、氧化物、单质)不同类别的物质,它们之间的关系如图所示(“-”表示相连的物质间能发生反应,“→”表示一种物质转化成另一种物质.反应条件、部分反应物和生成物已略去).反应C→A为化合反应,且在反应过程中放出大量热,D是人体胃液中的一种酸,请回答下列问题:
A、B、C、D、E为初中化学常见五种(酸、碱、盐、氧化物、单质)不同类别的物质,它们之间的关系如图所示(“-”表示相连的物质间能发生反应,“→”表示一种物质转化成另一种物质.反应条件、部分反应物和生成物已略去).反应C→A为化合反应,且在反应过程中放出大量热,D是人体胃液中的一种酸,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 类别 | 单质 | 构成物质微粒 | 有机化合物 | 常见的碱 |
| 物质 | 氧气、臭氧 | 分子、原子、离子 | 甲烷、乙醇 | 烧碱、纯碱 |
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com