
| A. | NaCl BaCl2 Na2SO4 | B. | Na2SO4 HCl KCl | ||
| C. | CuSO4 NaCl NaNO3 | D. | Na2CO3 NaCl Na2SO4 |
分析 pH为1.5的水溶液显酸性,水溶液中含有大量的H+;根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存;本题还要注意能得到无色溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
解答 解:pH为1.5的水溶液显酸性,水溶液中含有大量的H+:
A、BaCl2 和 Na2SO4在溶液中能相互交换成分生成硫酸钡沉淀和氯化钠,不能共存,故选项错误;
B、H+和Na2SO4 HCl KCl三者之间不能结合成沉淀、气体或水,能大量共存,且不存在有色离子,故选项正确;
C、H+和CuSO4 NaCl NaNO3三者之间不能结合成沉淀、气体或水,能大量共存,但CuSO4 溶液显蓝色,故选项错误;
D、H+和Na2CO3 中的碳酸根离子结合生成水和二氧化碳,不能大量共存,故选项错误;
故选B.
点评 本题考查物质的共存问题,判断物质在溶液中能否共存,主要看溶液中的各物质之间能否发生反应生成沉淀、气体、水;还要注意特定离子的颜色.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 编号 | 物质 | 杂质(少量) | 试剂 | 操作方法 |
| A | 氮气 | 氧气 | 铜 | 通过灼热的铜网 |
| B | 氯化亚铁溶液 | 氯化锌 | 足量铁 | 过滤 |
| C | 氯化钾 | 二氧化锰 | 水 | 溶解、过滤、洗涤、干燥 |
| D | 稀硫酸 | 稀盐酸 | 适量硝酸银溶液 | 过滤 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
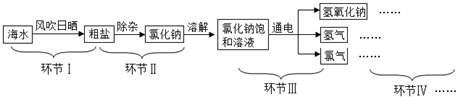
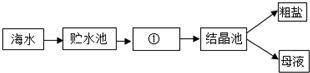
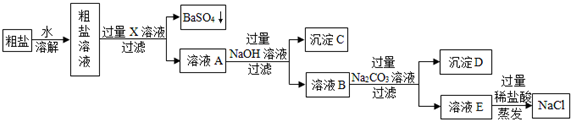
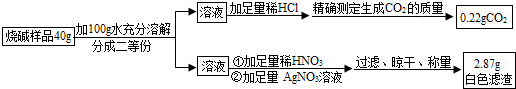
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
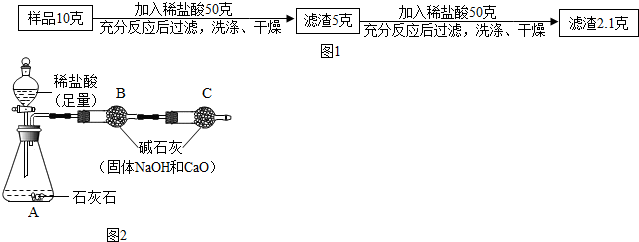
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
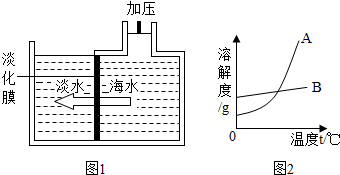
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
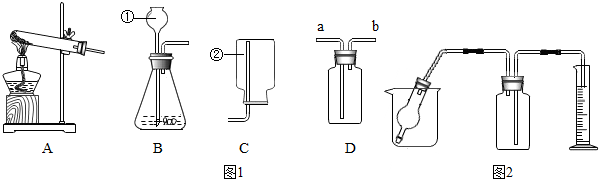
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com