
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 盐酸的质量/g | 20 | 40 | 60 |
| 生成气体的质量/s | 2.2 | 4.4 | 5.5 |
| 碳酸钠的质量 |
| 碱性调味液的质量 |
| 106 |
| x |
| 44 |
| 5.5g |
| 13.25g |
| 100g |


科目:初中化学 来源: 题型:
| A、加强建筑工地扬尘控制 |
| B、研发新能源汽车 |
| C、禁止焚烧秸秆 |
| D、发展燃煤发电 |
查看答案和解析>>
科目:初中化学 来源: 题型:
A、C
| |||||||
B、Cu
| |||||||
C、CaO
| |||||||
D、Fe
|
查看答案和解析>>
科目:初中化学 来源: 题型:
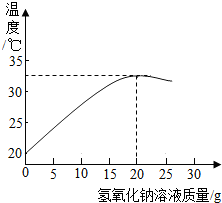 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 实验现象 |
| ①将几粒白色固体颗粒放在表面皿上,放置一会儿 | |
| ②将几粒白色固体颗粒放入盛有少量水的试管中,并用手触摸试管外壁 | 试管外壁温度明显升高(合理叙述均可) |
| ③向操作②得到的溶液中放入一段羊毛线,加热一段时间 | 羊毛线逐渐消失 |
查看答案和解析>>
科目:初中化学 来源: 题型:
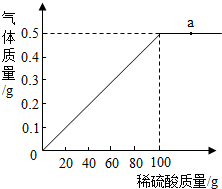 黄铜是以中国是铜锌合金,可用来制造机器、电器零件及日常用品.现取40g黄铜样品,向其中加入稀硫酸,反应生成的气体与所加稀硫酸的质量关系如图所示.
黄铜是以中国是铜锌合金,可用来制造机器、电器零件及日常用品.现取40g黄铜样品,向其中加入稀硫酸,反应生成的气体与所加稀硫酸的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:
| 称量的产品质量/g | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
| 加入纯碱产品质量/g | 1.4 | 2.8 | 5.6 | 7 |
| 烧杯中剩余物质量/g | 50.85 | 51.7 | 53.4 | 54.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 2013年12月,“嫦娥三号”探测器首次实现软着陆和月面巡视勘察.
2013年12月,“嫦娥三号”探测器首次实现软着陆和月面巡视勘察.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com