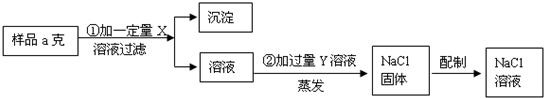
(2013?番禺区一模)某兴趣小组的同学在实验室用含有少量CaCl
2的NaCl固体配制一定质量分数的NaCl溶液.实验步骤如图所示:
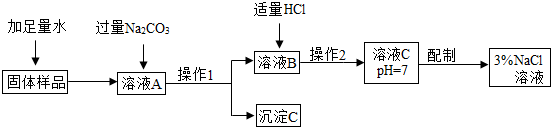
请回答:
(1)沉淀C的化学式为
CaCO3
CaCO3
.
(2)加入“过量Na
2CO
3”所发生反应的化学方程式为
CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
.
(3)在“操作1”用的实验方法是
过滤
过滤
.
(4)加入“适量HCl”的目的是
将溶液B中所含Na2CO3全部转化为NaCl,且溶液为中性
将溶液B中所含Na2CO3全部转化为NaCl,且溶液为中性
.
(5)“操作2”的目的是测定溶液为中性,测定溶液pH的方法是
在干燥玻璃片上放一片pH试纸,用干燥玻璃棒蘸取溶液并滴在pH试纸上,把试纸显示的颜色与比色卡对照,确定溶液的pH值
在干燥玻璃片上放一片pH试纸,用干燥玻璃棒蘸取溶液并滴在pH试纸上,把试纸显示的颜色与比色卡对照,确定溶液的pH值
.
(6)经测定“溶液C”是质量为50g,质量分数为6%的氯化钠溶液(密度为1.04g/cm
3).现要用该溶液配制50g质量分数为3%的氯化钠溶液,所需的氯化钠溶液和水的体积分别为
24
24
ml和
25
25
ml.(水密度为1.0g/cm
3).
配制过程中除要用到以下仪器外,还需要的玻璃仪器是
量筒、胶头滴管
量筒、胶头滴管
.