
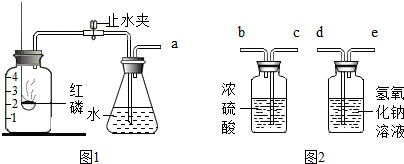
分析 (1)根据氧气约占空气体积的$\frac{1}{5}$解答;
(2)根据需要先除二氧化碳,再除水分解答;
(3)根据蜡烛燃烧生成二氧化碳,氢氧化钠溶液可与二氧化碳反应解答;
(4)根据反应原理写出反应的化学方程式解答;
(5)根据氮化镁和水反应生成氢氧化镁和氨气,氨气能使湿润的红色石蕊试纸变蓝色解答.
解答 解:(1)足量的红磷燃烧消耗氧气,生成五氧化二磷,冷却后,打开止水夹水倒流,水约占集气瓶空间容积的$\frac{1}{5}$;
(2)氢氧化钠溶液可以除去空气中的CO2;浓硫酸具有吸水性,可以除去空气中的水蒸气;除杂时都是长进短出,导管口之间的连接顺序是:d→e→c;
(3)蜡烛燃烧生成二氧化碳,氢氧化钠溶液可与二氧化碳反应,瓶内气压减小,冷却后,打开止水夹后,要确保液体的倒流并达到 (1)的现象,需进行的引发操作是从a中鼓入少量空气;
(4)镁条与氮气反应的化学方程式为:3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;属于化合反应;
(5)取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色,证明产物中存在Mg3N2.
答案:
(1)$\frac{1}{5}$;
(2)d→e→c;
(3)A;
(4)3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;化合反应;
(5)将生成的固体溶于水,产生有刺激性气味的气体并能使湿润红色石蕊试纸变蓝.
点评 本题考查了物质性质的实验探究,理解实验原理、掌握实验基本操作和镁及其化合物性质是解题关键,题目难度中等.


科目:初中化学 来源: 题型:实验探究题
| NH3 | N2 | NO | NO2 | |
| 顏色 | 无色 | 无色 | 无色 | 红棕色 |
| 溶解性 | 极易溶于水 | 不溶于水 | 不溶于水 | 可溶于水或硝酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用氯化钡区分稀盐酸和稀硫酸 | |
| B. | 用紫色石蕊溶液区分二氧化碳和一氧化碳 | |
| C. | 用水区分硝酸铵固体和氢氧化钠固体 | |
| D. | 用二氧化碳区分氯化钠溶液和氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
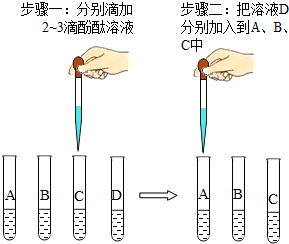 在实验台上有四瓶未贴标签的溶液,已知分別是碳酸钾溶液、氯化钠溶液、氯化钡溶液和稀硫酸.为了鉴别这四种溶液,在老师的指导下,兴趣小组的同学把这四种溶液按A、B、C、D进行编号,分别各取适量作为样品加入到四支试管中,进行了如图所示的探究活动:
在实验台上有四瓶未贴标签的溶液,已知分別是碳酸钾溶液、氯化钠溶液、氯化钡溶液和稀硫酸.为了鉴别这四种溶液,在老师的指导下,兴趣小组的同学把这四种溶液按A、B、C、D进行编号,分别各取适量作为样品加入到四支试管中,进行了如图所示的探究活动:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 西达苯胺由五种元素组成 | |
| B. | 西达苯胺中氢元素的质量分数为10% | |
| C. | 一个西达苯胺分子由50个原子构成 | |
| D. | 西达苯胺中碳、氢元素的质量比为22:19 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com