
| 步骤 | 操作 | 现象 | 结论 |
| 第一步 | 取样,加入少量盐酸 | 无气泡产生 | 废液中一定没有碳酸钠 |
| 第二步 | 再次取样,进行实验⑧ | 无白色沉淀产生 | 废液中只有氢氧化钠 |
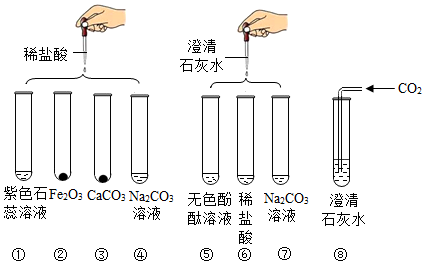
分析 (1)根据氧化铁和稀盐酸反应生成氯化铁和水,氯化铁溶于水呈黄色进行分析;
(2)根据碱能使酚酞变色、碱和稀盐酸反应生成盐和水、盐和酸都不能使酚酞变色进行分析;
(3)根据氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠进行分析;
(4)根据碳酸钠和稀盐酸反应生成气体、氯化钠和稀盐酸不反应进行分析;
(5)根据氢氧化钙和稀盐酸反应生成氯化钙和水,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠进行分析.
解答 解:(1)氧化铁和稀盐酸反应生成氯化铁和水,氯化铁溶于水呈黄色,化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)氢氧化钙能使酚酞变红色,稀盐酸和氢氧化钙反应生成氯化钙、水和二氧化碳,稀盐酸有可能过量但氯化钙和稀盐酸都不能使酚酞变色;
(3)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)碳酸钠和稀盐酸反应生成气体二氧化碳,氯化钠和稀盐酸不反应,所以固体中可能含有碳酸钠,一定含有氯化钠,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,该反应属于复分解反应;
(5)氢氧化钙和稀盐酸反应生成氯化钙和水,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以实验结束后,某同学将⑤⑥⑦三个试管的废液倒入同一个烧杯中,观察到废液呈浑浊并显红色,
①废液中除碳酸钙、氯化钠、水和指示剂外,一定还含有氢氧化钠;
②依据上述实验过程,引起废液呈碱性的物质组成可能只有氢氧化钠,可能是氢氧化钠和碳酸钠,也可能是氢氧化钠和氢氧化钙,共有3种可能;
③为了进一步探究废液的成分,该同学进行以下实验:
| 步骤 | 操作 | 现象 | 结论 |
| 第一步 | 取样,加入少量盐酸 | 无气泡产生 | 废液中一定没有碳酸钠 |
| 第二步 | 再次取样,进行实验⑧ | 无白色沉淀产生 | 废液中只有氢氧化钠 |
| 步骤 | 操作 | 现象 | 结论 |
| 第一步 | 取样,加入少量盐酸 | 无气泡产生 | 废液中一定没有碳酸钠 |
| 第二步 | 再次取样,进行实验⑧ | 无白色沉淀产生 | 废液中只有氢氧化钠 |
点评 本题综合考查了氢氧化钙的化学性质的探究,全面综合的考查,角度新颖,解答时抓住氢氧化钙的化学性质不难解答.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
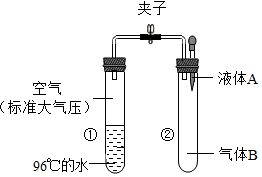 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )| A. | 水、一氧化碳气体 | B. | 硫酸、氮气 | ||
| C. | 硝酸银溶液、氯化钡粉末 | D. | 氢氧化钾溶液、二氧化碳气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
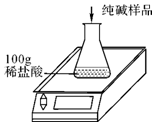 侯氏制碱法得到的纯碱产品中常含有少量氯化钠杂质.实验中取30g纯碱样品,平均分成五等份(每等分6克)依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表(假设反应产生气体全部逸出,其它物质的挥发忽略不计):
侯氏制碱法得到的纯碱产品中常含有少量氯化钠杂质.实验中取30g纯碱样品,平均分成五等份(每等分6克)依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表(假设反应产生气体全部逸出,其它物质的挥发忽略不计):| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 6 | 6 | 6 | 6 | 6 |
| 电子天平的示数/g | 163.8 | 167.6 | 171.4 | 177.4 | 183.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 烧杯中有铁无铜 | B. | 烧杯中有铜无铁 | C. | 烧杯中铁、铜都有 | D. | 烧杯中铁、铜都无 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金属或合金 | B. | 氧化物 | C. | 有机物 | D. | 盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com