

分析 本题的信息比较丰富,根据题意很容易解决本题.已知C为常用于灭火的气体,故C应为二氧化碳,A为是一种固体单质,它的组成元素可形成多种形态不同的单质,同时能够和二氧化碳反应生成能够和氧化铁反应的物质,我们可以判断E应该为一氧化碳,F应该为铁,进而我们可以判断A为碳单质,D为红色固体单质,D是铜,B就是氧化铜,据此解答.
解答 解:C为常用于灭火的气体,故C应为二氧化碳,A为是一种固体单质,它的组成元素可形成多种形态不同的单质,同时能够和二氧化碳反应生成能够和氧化铁反应的物质,我们可以判断E应该为一氧化碳,F应该为铁,进而我们可以判断A为碳单质,D为红色固体单质,D是铜,B就是氧化铜,带入框图,推断合理;
(1)B是氧化铜,故填:CuO;
(2)反应②是二氧化碳与碳高温反应生成一氧化碳,故填:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO;
(3)反应③是一氧化碳与氧化铁高温反应生成铁和二氧化碳,故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)A能组成金刚石、石墨等,故填:金刚石、石墨.
点评 本题为推断题对于推断题的解法,要根据题给条件和物质的化学特性找准突破口,然后顺藤摸瓜完成解答


科目:初中化学 来源: 题型:选择题
| A. | CO具有可燃性,可用作燃料 | |
| B. | 金刚石硬度大,可用来刻划玻璃 | |
| C. | 铁粉生锈会消耗氧气,可用作食品保鲜吸氧剂 | |
| D. | 氮气稳定,可用作保护气 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
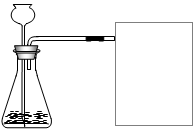 学校化学兴趣小组知道二氧化锰能做过氧化氢分解的催化剂后,想要探究两个问题:第一想探究其它一些物质如氧化铝是否也可做过氧化氢的催化剂?第二想探究不同催化剂对过氧化氢分解快慢是否有影响?请你一起参与他们的探究过程,并填写下列空白.
学校化学兴趣小组知道二氧化锰能做过氧化氢分解的催化剂后,想要探究两个问题:第一想探究其它一些物质如氧化铝是否也可做过氧化氢的催化剂?第二想探究不同催化剂对过氧化氢分解快慢是否有影响?请你一起参与他们的探究过程,并填写下列空白.| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液分解速率太慢,产生的氧气太少 |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量氧化铝,再将带火星木条伸入试管中 | 木条复燃 | 加入Al2O3能加快过氧化氢溶液的分解速率 |
| 实验编号 | 1 | 2 |
| 反应物 | 5%H2O2 | 5%H2O2 |
| 催化剂 | 1g氧化铝 | 1gMnO2 |
| 时间 | 85秒 | 46秒 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
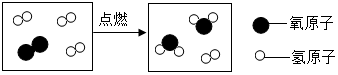
| A. | 该反应有单质生成 | |
| B. | 参加反应的“ ”分子与“ ”分子与“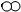 ”分子的个数比为1:8 ”分子的个数比为1:8 | |
| C. | 分子是化学变化中最小粒子 | |
| D. | 如图表示的微观变化过程中共有三种分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |
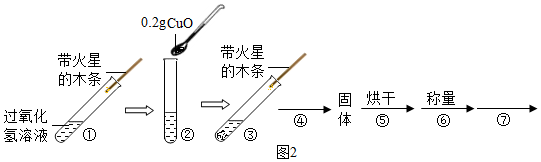
| 步骤③现象 | 步骤⑥结果 | 步骤⑦操作 | 结论 |
| 有大量气泡产生. | 称得氧化铜质量为0.2g. | 将固体加入盛有5mL 5%过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象. | 在过氧化氢溶液的分解实验中,氧化铜也能作催化剂. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图是电解水的实验装置.下列说法中,正确的是( )
如图是电解水的实验装置.下列说法中,正确的是( )| A. | 电解水的方程式为2H2O=H2↑+O2↑ | |
| B. | 实验说明水是甶氢原子和氧原子构成的 | |
| C. | 2管内产生的气体能使木条复燃 | |
| D. | 1、2两试管产生的气体质量之比为2:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
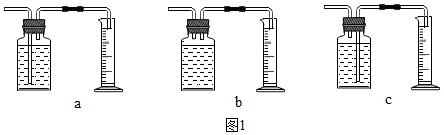
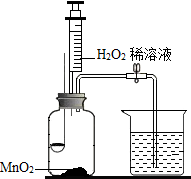 用如图所示装置,在常温下分别进行探究燃烧条件和探究氧气性质的试验.已知:白磷的着火点为40℃..
用如图所示装置,在常温下分别进行探究燃烧条件和探究氧气性质的试验.已知:白磷的着火点为40℃..| 步骤 | 实验1:探究燃烧条件 | 实验2:探究氧气性质 |
| Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中的导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有澄清石灰水,燃烧匙中放入木炭,点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com