
| 微粒结构 示意图 | 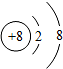 | 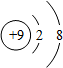 | 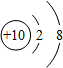 | 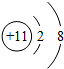 | 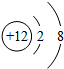 |
| 微粒类型 | 阴离子 | 阴离子 | 原子 | 阳离子 | 阳离子 |
| 微粒所带 电荷 | 2个单位负电荷 | 1个单位负电荷 | 不显电性 | 1个单位正电荷 | 2个单位正电荷 |
| 化合价 | -2 | -1 | 0 | +1 | +2 |
分析 (1)弄清原子结构示意图和离子结构示意图所表示的意义,带负电荷的是阴离子:质子数<电子数,带正电荷的是阳离子:质子数>电子数,不显电性的是原子:质子数=电子数,而且离子所带电荷数与化合价数相等,正负相同.
(2)
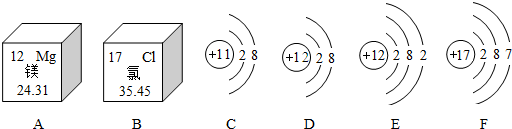
①由两种元素在元素周期表中的信息和4种粒子的结构示意图,可知C、D、E、F中,属于同种元素的,最容易得到电子的.
②由A和B的原子结构示意图,可推测形成的化合物的化学式.
③写出一条从图A中获得的信息,如:镁原子序数为12;相对原子质量为24;为金属元素等.
解答 解:
(1)在原子中,质子数=电子数,不显电性;在离子中,质子数不等于电子数,质子数>电子数,带正电荷的是阳离子,该元素在化合物中显正价;质子数<电子数,带负电荷的是阴离子,该元素在化合物中显负价,而且离子所带的电荷数等于其元素的化合价数,正负相同.
(2)①由两种元素在元素周期表中的信息和4种粒子的结构示意图,可知C、D、E、F中,属于同种元素的是D、E,最容易得到电子的是F.故填:D、E,F;
②由A和B的原子结构示意图,可知A易失去2个电子,B易得到1个电子;故A和B形成的化合物的化学式是MgCl2.故填:MgCl2;
③根据元素周期表提供的信息,可知从图A中获得的信息:镁元素的质子数12(或镁元素的核外电子数为12 或 镁元素的相对原子质量为24.31);故答案为:镁元素的质子数12:镁元素的核外电子数为12:镁元素的相对原子质量为24.31.
故答案为:
(1)
①所带电荷数与最外层电子数不等的原子是离子;
②质子数与核外电子数相等的是原子;
(2)
①DE F
②MgCl2;
③镁元素的质子数12
点评 主要考查了原子、离子的结构示意图所表示的意义及阴阳离子、原子的特点,培养学生的观察能力和总结知识的能力.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
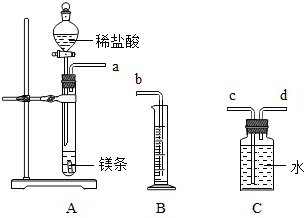 请利用图给定的仪器组装成一套测定镁的相对原子质量的实验装置(每种仪器只允许使用一次),用排水法测量化学反应产生氢气的体积,根据化学方程式计算出镁的相对原子质量,回答问题:
请利用图给定的仪器组装成一套测定镁的相对原子质量的实验装置(每种仪器只允许使用一次),用排水法测量化学反应产生氢气的体积,根据化学方程式计算出镁的相对原子质量,回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com