
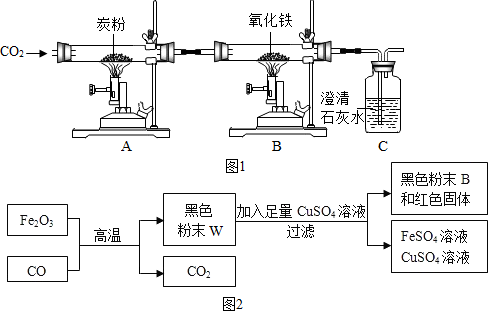
| 方案 | 实验操作 | 可能的现象 | 结论 |
| ① | 取适量黑色粉末W用磁铁吸引 | 黑色粉末全部被吸引 | 猜想1正确 |
| ② | 取适量黑色粉末W用磁铁吸引 | 黑色粉末部分被吸引 | 猜想2正确 |
| ③ | 取适量黑色粉末R用加入足量稀盐酸 | 黑色粉末全部溶解 | 猜想3正确 |
| ④ | 取适量黑色粉末R用磁铁吸引 | 黑色固体部分被吸引 | 猜想4正确 |
分析 (1)根据碳和二氧化碳反应生成一氧化碳解答;
(2)根据实验的注意事项进行分析;
(3)【进行猜想】①根据化学反应的原理来分析;
②根据实验现象来分析;
③根据氧化铁的颜色来分析;
根据物质的组成来分析;
【反思提高】运用四氧化三铁能被磁铁吸引且也是黑色的知识进行解答
根据反应的原理来分析解答.
解答 解:(1)二氧化碳和碳在高温下生成一氧化碳,化学方程式为CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;故填:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
(2)一氧化碳有毒,会污染空气,所以应该将其燃烧,转化为二氧化碳.故填:缺少尾气处理装置;
(3)①在高温的条件下,一氧化碳将氧化铁还原为铁,同时生成二氧化碳,其中一氧化碳充当还原剂;故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;还原;
②黑色粉末W与足量的硫酸铜溶液反应后仍有黑色固体存在,说明其中含有铁的氧化物,故填:黑色粉末W与足量的硫酸铜溶液反应后仍有黑色固体存在;
③氧化铁是一种红棕色固体,而M是黑色的,所以不含氧化铁,故填:氧化铁是红棕色的固体;
黑色粉末W由铁粉、四氧化三铁(Fe2O3)、氧化亚铁(FeO)组成;故填:铁粉、四氧化三铁(Fe2O3)、氧化亚铁(FeO);
由于猜想③是需要证明三种物质的存在,所以取适量黑色粉末R用磁铁吸引由于四氧化三铁能被磁铁吸引,所以只要黑色粉末部分被吸引,就说明该物质中存在氧化亚铁和四氧化三铁,结合固体R的成分中含有红色固体铜的形成过程可知混合物中还含有单质的铁,是因为铁能与硫酸铜反应生成单质的铜.故填:黑色固体部分被吸引;
【反思提高】四氧化三铁也能被磁铁吸引,四氧化三铁也能和稀盐酸反应,所以方案②和方案③中得出的结论都不正确;故填:若有四氧化三铁(Fe3O4)存在,现象相同(或者不能证明没有四氧化三铁(Fe3O4),合理即可);
Fe3O4溶于稀盐酸生成FeCl3、FeCl2和水,其反应方程式可表示为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;故填:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
Fe3O4也能溶于稀硝酸(HNO3),反应生成Fe(NO3)3、NO和水,方程式为:3Fe3O4+28HNO3=9Fe(NO3)3+NO+14H2O;故填:3Fe3O4+28HNO3=9Fe(NO3)3+NO+14H2O.
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 水是一种重要的资源.
水是一种重要的资源.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 研究金属活动性强弱,对合理利用金属资源有着重要意义.同学们通过以下活动进行了铁、铝、铜三种金属活动下的研究,都得到了正确的结论:
研究金属活动性强弱,对合理利用金属资源有着重要意义.同学们通过以下活动进行了铁、铝、铜三种金属活动下的研究,都得到了正确的结论:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com