解:(1)①根据密度大于空气的气体可用向上排气法收集、密度小于空气的气体可采取向下排气法收集、不溶于水的气体可用排水法收集,由于氨气密度小于空气的密度且极易溶于水,因此收集氨气时只能采取向下排空气法收集;
②由反应的化学方程式NH
3+CO
2+H
2O+NaCl═NaHCO
3+A,可知反应前各原子个数为
反应前 反应后
Na原子 1 1
Cl原子 1 0
N原子 1 0
H原子 5 1
C原子 1 1
O原子 3 3
根据反应前后原子种类、数目不变,可判断生成物A的一个分子由4个H原子、1个N原子、1个Cl原子构成,4个H原子与1个N原子可形成NH
4+,因此可确定物质A的化学式可表示为NH
4Cl;
NH
4Cl中氮元素与氢元素的质量比=14:(1×4)=7:2;
③由化学方程式6NH
3+5CH
3OH+12B═3N
2+5CO
2+19H
2O,可知反应前后各原子的个数为
反应前 反应后
N原子 6 6
H原子 38 38
C原子 5 5
O原子 5 29
根据反应前后原子种类、数目不变,可判断反应物B的12个分子中含有24个O原子,则每个B分子由2个O原子构成,物质B的化学式为O
2;
(2)①设化合物NH
4ClO
4中氯元素的化合价为x,由NH
4+、O化合价分别为+1、-2,根据化合物中各元素化合价代数和为0,有(+1)+x+(-2)×4=0,解得x=+7;
②该反应由一种物质NH
4ClO
4发生反应生成了N
2、Cl
2、O
2、X四种物质,属于“一变多”的分解反应;
③由化学方程2NH
4ClO
4
N
2↑+Cl
2↑+2O
2↑+4X,可知反应前后各原子的个数为
反应前 反应后
N原子 2 2
H原子 8 0
Cl原子 2 2
O原子 8 4
根据反应前后原子种类、数目不变,可判断生成物X的4个分子中含8个H原子和4个O原子,每个X分子由2个H原子和1个O原子构成,则物质X的化学式为H
2O;
故答案为:(1)①向下排空气;②NH
4Cl;7:2;③O
2;(2)①+7;②分解;③H
2O.
分析:(1)①根据收集气体的方法与气体密度、溶解性的关系,利用氨气的性质,确定收集氯气的方法;
②根据反应前后原子种类、数目不变,利用反应的化学方程式,判断生成物A的分子构成,确定物质A的化学式;并利用化学式计算其中N、H元素的质量比;
③根据反应前后原子种类、数目不变,利用反应的化学方程式,判断反应物B的分子构成,确定物质B的化学式;
(2)①根据化合物中各元素化合价代数和为0,利用化合物的化学式计算其中Cl元素的化合价;
②根据分解反应的概念,利用反应由一种物质生成多种物质的反应特点,判断反应的分类;
③根据反应前后原子种类、数目不变,利用反应的化学方程式,判断生成物X的分子构成,确定物质X的化学式.
点评:根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.

 N2↑+Cl2↑+2O2↑+4X.请回答下列问题:
N2↑+Cl2↑+2O2↑+4X.请回答下列问题: N2↑+Cl2↑+2O2↑+4X,可知反应前后各原子的个数为
N2↑+Cl2↑+2O2↑+4X,可知反应前后各原子的个数为

 灵星计算小达人系列答案
灵星计算小达人系列答案
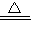 Ca(NO3)2+2NH3↑+2H2O反应.若准确称取某硝酸铵氮肥样品8.5g,与足量的熟石灰混合充分反应后,最多生成1.7g氨气(NH3),确定该氮肥样品中硝酸铵的纯度.
Ca(NO3)2+2NH3↑+2H2O反应.若准确称取某硝酸铵氮肥样品8.5g,与足量的熟石灰混合充分反应后,最多生成1.7g氨气(NH3),确定该氮肥样品中硝酸铵的纯度.