把一瓶稀盐酸平均分成两份装在甲、乙两个烧杯中,把等质量的碳酸镁和碳酸钠粉末分别放入甲、乙两个烧杯中,待反应停止后发现:甲烧杯中碳酸镁有剩余,乙烧杯中碳酸钠全部消失.根据该现象分析,下列结论可能正确的是( )
A.甲烧杯产生的气体多
B.乙烧杯产生的气体多
C.甲、乙两个烧杯中产生的气体一样多
D.无法判断
【答案】
分析:根据反应方程式:
MgCO
3+2HCl=MgCl
2+H
2O+CO
2↑
84 73 44
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 73 44
一种情况:碳酸镁有剩余,而碳酸钠和盐酸恰好完全反应,则产生二氧化碳的量都是根据盐酸来算,所以此时两者的二氧化碳量一样;
另一种情况:碳酸镁有剩余,而对于碳酸钠而言,盐酸也是剩余的.即盐酸对于碳酸钠来说过量,对于碳酸镁来说不足,进行分析解答.
解答:解:设碳酸镁和碳酸钠的质量都是x
MgCO
3+2HCl=MgCl
2+H
2O+CO
2↑
84 73 44
x


Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 73 44
x
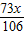

根据题意:反应结束,碳酸镁有剩余,碳酸钠消失;
说明盐酸的质量在

~

之间,
若盐酸质量刚好为
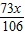
时,则产生二氧化碳的量都是根据盐酸来算,算出来二氧化碳的质量都是

;
所以此时两者的二氧化碳量一样,为C.;
而另一种情况就是盐酸对于碳酸钠来说过量,对于碳酸镁来说不足,即
盐酸的质量在

~

之间,产生的二氧化碳,碳酸镁对应的就是大于是

,碳酸钠对应的依然是

,
所以此时甲烧杯二氧化碳多,为A;
故选AC.
点评:本题主要考查学生对完全反应和不完全反应的概念的区别,以及运用知识进行推断的能力.学生需全面分析,才能正确选择.



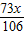

 ~
~ 之间,
之间,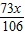 时,则产生二氧化碳的量都是根据盐酸来算,算出来二氧化碳的质量都是
时,则产生二氧化碳的量都是根据盐酸来算,算出来二氧化碳的质量都是 ;
; ~
~ 之间,产生的二氧化碳,碳酸镁对应的就是大于是
之间,产生的二氧化碳,碳酸镁对应的就是大于是 ,碳酸钠对应的依然是
,碳酸钠对应的依然是 ,
,

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案